スーパーオキシドディスムターゼ 目次 反応 類型 脚注 参考文献 関連項目 外部リンク 案内メニュー1.15.1.19054-89-1 IntEnz viewBRENDA entryNiceZyme viewKEGG entrymetabolic pathwayprofileRCSB PDBPDBjPDBePDBsumAmiGO EGO articlesarticlesproteins1VAR860517728557362SOD7175933“Crystal Structure of Bovine Cu,Zn Superoxide Dismutase at 3Å Resolution: Chain Tracing and Metal Ligands.”432531105541063161501N0J1394426研究最前線、Superoxide dismutaseとその役割
EC 1.15抗酸化物質金属タンパク質
細胞活性酸素酵素霊長類ヒトスーパーオキシドアニオン酸素過酸化水素不均化酸化還元酵素銅イオン亜鉛マンガン金属酸化ストレスニッケルカタラーゼペルオキシダーゼがん細胞抗がん剤CuMnFeNi金属カチオン銅亜鉛マンガン鉄ニッケル補因子ヒト哺乳動物脊椎動物SOD1SOD2ミトコンドリアSOD3
(function()var node=document.getElementById("mw-dismissablenotice-anonplace");if(node)node.outerHTML="u003Cdiv class="mw-dismissable-notice"u003Eu003Cdiv class="mw-dismissable-notice-close"u003E[u003Ca tabindex="0" role="button"u003E非表示u003C/au003E]u003C/divu003Eu003Cdiv class="mw-dismissable-notice-body"u003Eu003Cdiv id="localNotice" lang="ja" dir="ltr"u003Eu003Cpu003Eu003Ca href="https://meta.wikimedia.org/wiki/Community_health_initiative/Partial_blocks/ja" class="extiw" title="m:Community health initiative/Partial blocks/ja"u003E部分ブロックu003C/au003Eに関する方針改訂が6月1日に行われました(u003Ca href="/wiki/Wikipedia:%E4%BA%95%E6%88%B8%E7%AB%AF/subj/%E9%83%A8%E5%88%86%E3%83%96%E3%83%AD%E3%83%83%E3%82%AF%E5%B0%8E%E5%85%A5%E3%81%AE%E6%98%AF%E9%9D%9E" title="Wikipedia:井戸端/subj/部分ブロック導入の是非"u003E詳細u003C/au003E)。nu003C/pu003Eu003C/divu003Eu003C/divu003Eu003C/divu003E";());
スーパーオキシドディスムターゼ
ナビゲーションに移動
検索に移動
| スーパーオキシドディスムターゼ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
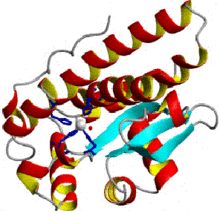 ヒトのMnのスーパーオキシドディスムターゼの単量体の構造。[1] | |||||||||
| 識別子 | |||||||||
| EC番号 | 1.15.1.1 | ||||||||
| CAS登録番号 | 9054-89-1 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| 遺伝子オントロジー | AmiGO / EGO | ||||||||
| |||||||||
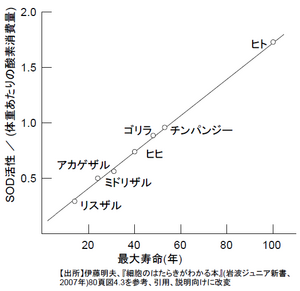
SOD活性と寿命との関係
スーパーオキシドディスムターゼ (Superoxide dismutase, SOD) は、細胞内に発生した活性酸素を分解する酵素である[2]。酸素消費量に対するSODの活性の強さと、寿命に相関があると言われるが、これは体重に対して消費する酸素の量が多い動物種ほど寿命が短くなるはずのところを、SODが活性酸素を分解することで寿命を延ばしているとするものであり、動物の中でも霊長類、とくにヒトはSODの活性の高さが際立ち、ヒトが長寿である原因のひとつとされている[3]。
SODは、スーパーオキシドアニオン(・O2-)を酸素と過酸化水素へ不均化する酸化還元酵素である。活性中心に銅(II)イオンと亜鉛(II)イオン(Cu, ZnSOD)、またはマンガン(III)イオン(MnSOD)や鉄(III) イオン(FeSOD)のように二価または三価の金属イオンを持った酵素で、細胞質(Cu, ZnSOD) やミトコンドリア(MnSOD)に多く局在している。酸化ストレスを減少させる役割を持つ。最近、ニッケルを持つ酵素(NiSOD)も発見されている。生成した過酸化水素はカタラーゼやペルオキシダーゼなどによって分解される。
がん細胞では活性酸素が高頻度に産生されており、SODの阻害に感受性を示す場合があるため、抗がん剤の標的として研究が行われている。
目次
1 反応
2 類型
2.1 一般
2.2 ヒト
3 脚注
4 参考文献
5 関連項目
6 外部リンク
反応
SODの触媒機能による活性酸素の分解反応の半反応式は以下のとおりである。
- M(n+1)+−SOD+O2−⟶Mn+−SOD+O2displaystyle ce M^(mathit n+1)^+-SOD+O2^-->M^mathit n+-SOD+O2
- Mn+−SOD +O2−+2H+⟶M(n+1)+−SOD+H2O2displaystyle ce M^mathit n+-SOD +O2^-+2H^+->M^(mathit n+1)^+-SOD+H2O2
ここで言うMは次のとおり。M = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2)
この反応で、金属カチオンの酸化状態はnとn+1の間を変動している。
類型
一般
Irwin FridovichとJoe M. McCordによって発見されたSOD酵素群は以前、未知の機能をもつ金属タンパク質と考えられていた[4]。SODにはいくつかの類型があり、それらタンパク質には銅や亜鉛、マンガン、鉄またはニッケルが補因子として含まれる。

ウシ亜科のCu-Zn SODサブユニット[5]
SODには金属補因子の種類により、Cu/Znタイプ(CuとZnの両方と結合する)、Fe・Mnタイプ(FeとMnのどちらかと結合する)、Niタイプ(Niと結合する)の3つのタイプに大別される。
- 銅/亜鉛 - 主に真核生物に使われるタイプ。事実上すべての真核細胞の細胞質基質はCu-Zn-SODを含む。市販されているCu-Zn-SODは通常はウシ亜科の細胞から精製されているものである。Cu-Zn-SODは分子量32,500のホモ二量体である。ウシ亜科のCu-Zn-SODは1975年に初めて構造が解明されたSODである[6]。8本のストランドがグリークキーでβバレルを形成した構造をしており、活性部位はバレルと表面ループとの間にある。2つのサブユニットは主に疎水的、静電気的相互作用により背中合わせに強く結合している。銅および亜鉛は6個のヒスチジンと1個アスパラギン酸側鎖に配位しており、1つのヒスチジンは2つの金属原子の間で共有されている[7]。
- 鉄/マンガン - 原核生物、原生生物およびミトコンドリア内で使われるタイプ。
- 鉄 - E. coliと多くのバクテリアがFe-SODを含む。いくつかのバクテリアはFe-SODであるが、その他はMn-SODで、さらに両方含むものもある。Fe-SODは植物の色素体で見られる。立体構造ではFeおよびMn-SODは同じαヘリックスの配置を持ち、その活性部位のアミノ酸側鎖の配置も同じである。
- マンガン - 鶏の肝臓のミトコンドリアと多くのバクテリアがMn-SODを含む。Mn-SODはヒトのミトコンドリアでも見られる。マンガンイオンの配位子は3個のヒスチジン側鎖、1個のアスパラギン酸側鎖と水またはヒドロキシ配位子で、マンガンの酸化数(IIとIII)に依存する[8]。
- ニッケル - 原核生物に含まれる。右巻きの4-ヘリックスバンドルからなる六量体構造で、それぞれニッケルイオンをキレートするN末端フックを含む。
ヒト
ヒト(すべての哺乳動物と大部分の脊椎動物も)では3種のSODが存在する。SOD1は細胞質、SOD2はミトコンドリア、SOD3は細胞外空間に存在する。SOD1は2つのユニットからなる二量体であるが、他の2種は4つのユニットからなる四量体である。SOD1とSOD3は銅と亜鉛を含むのに対し、SOD2はマンガンを活性中心に持つ。
脚注
^ PDB 1VAR; Borgstahl GE, Parge HE, Hickey MJ, Johnson MJ, Boissinot M, Hallewell RA, Lepock JR, Cabelli DE, Tainer JA (April 1996). “Human mitochondrial manganese superoxide dismutase polymorphic variant Ile58Thr reduces activity by destabilizing the tetrameric interface”. Biochemistry 35 (14): 4287–97. doi:10.1021/bi951892w. .mw-parser-output cite.citationfont-style:inherit.mw-parser-output .citation qquotes:"""""""'""'".mw-parser-output .citation .cs1-lock-free abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .citation .cs1-lock-limited a,.mw-parser-output .citation .cs1-lock-registration abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .citation .cs1-lock-subscription abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registrationcolor:#555.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration spanborder-bottom:1px dotted;cursor:help.mw-parser-output .cs1-ws-icon abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/4/4c/Wikisource-logo.svg/12px-Wikisource-logo.svg.png")no-repeat;background-position:right .1em center.mw-parser-output code.cs1-codecolor:inherit;background:inherit;border:inherit;padding:inherit.mw-parser-output .cs1-hidden-errordisplay:none;font-size:100%.mw-parser-output .cs1-visible-errorfont-size:100%.mw-parser-output .cs1-maintdisplay:none;color:#33aa33;margin-left:0.3em.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-formatfont-size:95%.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-leftpadding-left:0.2em.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-rightpadding-right:0.2em
PMID 8605177.
^ 伊藤 2007, p.79
^ 伊藤 2007, p.80
^ McCord JM, Fridovich I (1988). “Superoxide dismutase: the first twenty years (1968-1988)”. Free Radic. Biol. Med. 5 (5-6): 363–9. doi:10.1016/0891-5849(88)90109-8.
PMID 2855736.
^ PDB 2SOD;Tainer JA, Getzoff ED, Beem KM, Richardson JS, Richardson DC (September 1982). “Determination and analysis of the 2 A-structure of copper, zinc superoxide dismutase”. J. Mol. Biol. 160 (2): 181–217.
PMID 7175933.
^ Richardson JS, Thomas KA, Rubin BH, Richardson DC (1975). “Crystal Structure of Bovine Cu,Zn Superoxide Dismutase at 3Å Resolution: Chain Tracing and Metal Ligands.”. Proc Nat Acad Sci USA 72 (4): 1349–53. doi:10.1073/pnas.72.4.1349. PMC: 432531.
PMID 1055410. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC432531/. .
^ Tainer JA, Getzoff ED, Richardson JS, Richardson DC (1983). “Structure and mechanism of copper, zinc superoxide dismutase.”. Nature 306 (5940): 284–7. doi:10.1038/306284a0.
PMID 6316150. .
^ PDB 1N0J; Borgstahl GE, Parge HE, Hickey MJ, Beyer WF Jr, Hallewell RA, Tainer JA (1992). “The structure of human mitochondrial manganese superoxide dismutase reveals a novel tetrameric interface of two 4-helix bundles.”. Cell 71 (1): 107–18. doi:10.1016/0092-8674(92)90270-M.
PMID 1394426.
参考文献
- 伊藤明夫『細胞のはたらきがかわる本』株式会社 岩波書店〈岩波ジュニア新書〉、2007年。
ISBN 978-4-00-500575-8。
関連項目
- ムターゼ
- 脂質過酸化反応
外部リンク
研究最前線、Superoxide dismutaseとその役割 (放射線医学総合研究所)
カテゴリ:
- EC 1.15
- 抗酸化物質
- 金属タンパク質
(RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.320","walltime":"0.444","ppvisitednodes":"value":6278,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":83548,"limit":2097152,"templateargumentsize":"value":12697,"limit":2097152,"expansiondepth":"value":22,"limit":40,"expensivefunctioncount":"value":1,"limit":500,"unstrip-depth":"value":1,"limit":20,"unstrip-size":"value":24663,"limit":5000000,"entityaccesscount":"value":0,"limit":400,"timingprofile":["100.00% 356.108 1 -total"," 47.49% 169.131 6 Template:Cite_journal"," 42.63% 151.795 6 Template:Citation/core"," 27.90% 99.354 1 Template:Enzyme"," 25.66% 91.360 12 Template:Citation/identifier"," 25.22% 89.815 1 Template:Infobox2"," 19.45% 69.272 1 Template:Cite_book"," 16.18% 57.618 6 Template:PMID"," 15.96% 56.841 1 Template:Cite_book/和書"," 15.88% 56.554 7 Template:Catalog_lookup_link"],"scribunto":"limitreport-timeusage":"value":"0.046","limit":"10.000","limitreport-memusage":"value":2373748,"limit":52428800,"cachereport":"origin":"mw1324","timestamp":"20190522141544","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"u30b9u30fcu30d1u30fcu30aau30adu30b7u30c9u30c7u30a3u30b9u30e0u30bfu30fcu30bc","url":"https://ja.wikipedia.org/wiki/%E3%82%B9%E3%83%BC%E3%83%91%E3%83%BC%E3%82%AA%E3%82%AD%E3%82%B7%E3%83%89%E3%83%87%E3%82%A3%E3%82%B9%E3%83%A0%E3%82%BF%E3%83%BC%E3%82%BC","sameAs":"http://www.wikidata.org/entity/Q410776","mainEntity":"http://www.wikidata.org/entity/Q410776","author":"@type":"Organization","name":"Contributors to Wikimedia projects","publisher":"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2003-12-06T02:14:38Z","dateModified":"2018-11-23T21:17:17Z","image":"https://upload.wikimedia.org/wikipedia/commons/0/0b/SOD.gif"(RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":117,"wgHostname":"mw1243"););

