Супероксиддисмутаза Содержание Реакция | Типы | Биохимия | Физиология | Роль в патологии | Ссылки | См. также | Ссылки | НавигацияSOD19054-89-1664711179147450NM_000454P004411.15.1.121q22.1SOD29054-89-1664811180147460NM_000636P041791.15.1.16q25SOD39054-89-1664911181185490NM_003102P082941.15.1.141.15.1.11SXA1N0J1ISAFree text — PDF 333kB147450147460185490105400Амиотрофический латеральный склерозХороший обзор литературы по СОД.Damage-Based Theories of Aging
Гены 21-й хромосомыБелки по алфавитуФерменты по алфавитуГены 6-й хромосомыГены 4-й хромосомыАнтиоксидантыМеталлопротеиныКФ 1.15.1
КФ1.15.1.1антиоксидантных ферментовкаталазойкислородных радикаловдисмутациюсупероксидакислородпероксид водородаантиоксидантноймолочнокислые бактериидисмутацииметаллCuMnFeNiокислительное состояниекатионакофактораактивного центра ферментаCuZnмедьцинкконформациюMnмарганцемFeжелезомNiникелемцитоплазмемитохондрииСОД3хромосомахоксид азотапероксинитритдиффузионно-лимитированная реакцияоксидативный стрессСОД1амиотрофический латеральный склерознейронов
Супероксиддисмутаза
Перейти к навигации
Перейти к поиску
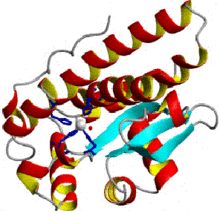
Структура митохондриальной супероксиддисмутазы человека
супероксиддисмутаза 1, цитозольная | |
|---|---|
| Обозначения | |
| Символы | SOD1; ALS, ALS1 |
| CAS | 9054-89-1 |
| Entrez Gene | 6647 |
| HGNC | 11179 |
| OMIM | 147450 |
| RefSeq | NM_000454 |
| UniProt | P00441 |
| Другие данные | |
| Шифр КФ | 1.15.1.1 |
| Локус | 21-я хр., 21q22.1 |
супероксиддисмутаза 2, митохондриальная | |
|---|---|
| Обозначения | |
| Символы | SOD2 |
| CAS | 9054-89-1 |
| Entrez Gene | 6648 |
| HGNC | 11180 |
| OMIM | 147460 |
| RefSeq | NM_000636 |
| UniProt | P04179 |
| Другие данные | |
| Шифр КФ | 1.15.1.1 |
| Локус | 6-я хр., 6q25 |
супероксиддисмутаза 3, внеклеточная | |
|---|---|
| Обозначения | |
| Символы | SOD3 |
| CAS | 9054-89-1 |
| Entrez Gene | 6649 |
| HGNC | 11181 |
| OMIM | 185490 |
| RefSeq | NM_003102 |
| UniProt | P08294 |
| Другие данные | |
| Шифр КФ | 1.15.1.1 |
| Локус | 4-я хр., 4 pter-q21 |
Супероксиддисмутаза (СОД, КФ 1.15.1.1) относится к группе антиоксидантных ферментов. Вместе с каталазой и другими антиоксидантными ферментами она защищает организм человека от постоянно образующихся высокотоксичных кислородных радикалов. Супероксиддисмутаза катализирует дисмутацию супероксида в кислород и пероксид водорода. Таким образом, она играет важнейшую роль в антиоксидантной защите практически всех клеток, так или иначе находящихся в контакте с кислородом. Одним из редких исключений является молочнокислая бактерия Lactobacillus plantarum и родственные ей молочнокислые бактерии, использующие иной механизм защиты от образующегося супероксида.
Содержание
1 Реакция
2 Типы
2.1 Введение
2.2 Человек
3 Биохимия
4 Физиология
5 Роль в патологии
6 Ссылки
7 См. также
8 Ссылки
Реакция |
Реакцию дисмутации супероксида, катализируемую супероксиддисмутазой, можно разбить на две части (парциальные реакции) следующим образом:
- M(n+1)+ − СОД + O2− → Mn+ − СОД + O2
- Mn+ − СОД + O2− + 2H+ → M(n+1)+ − СОД + H2O2.
где M (переходный металл) = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2).
В данной реакции окислительное состояние катиона металла осцилирует между n и n+1.
Типы |
Введение |
Существует несколько форм супероксиддисмутазы в зависимости от типа переходного металла-кофактора активного центра фермента: Cu,Zn-СОД (медь как кофактор активного центра и цинк как кофактор, стабилизирующий конформацию), Mn-СОД (с марганцем в активном центре), а также менее распространённые Fe-СОД (с железом)) и Ni-СОД (с никелем).
Цитозоль практически всех эукариотических клеток содержит супероксиддисмутазу типа Cu,Zn-СОД. Это самая распространённая супероксиддисмутаза и единственная коммерчески доступная форма фермента (как правило выделенная либо из эритроцитов, либо из печени быка: PDB 1SXA, EC 1.15.1.1). Cu,Zn-СОД является гомодимером (то есть состоящим из двух одинаковых субъединиц), молекулярная масса 32,5 кДа. Субъединицы белка связаны друг с другом в первую очередь гидрофобными и электростатическими связями. Медь и цинк связаны с белковой частью молекулы через гистидиновые остатки.
Митохондрии эукариотических клеток и многие бактерии содержат супероксиддисмутазу с Mn (Mn-СОД). Например, митохондриальная СОД человека: PDB 1N0J, EC 1.15.1.1, молекулярная масса 86-88 кДа. Марганец в этом ферменте координирован с белком через 3 гистидина и аспартат и с водой либо гидроксильным лигандом в зависимости от окислительного состояния Mn (Mn(II) или Mn(III)).
E. coli и многие другие бактерии содержат формы фермента с железом (Fe-СОД), другие — с марганцем (Mn-СОД), а некоторые — оба эти типа. (E. coli Fe-SOD: PDB 1ISA, EC 1.15.1.1). Активные центры Mn- и Fe-СОД содержат те же аминокислоты в боковых цепях.

Структура активного центра митохондриальной супероксиддисмутазы человека (СОД2)
Человек |
В организме человека существует три типа СОД. СОД1 находится в цитоплазме, СОД2 — в митохондрии, а СОД3 — это внеклеточная (экстраклеточная) форма. Первая форма — димерная, тогда как вторая и третья формы — тетрамерные (состоящие из 4 равных субъединиц). СОД1 и СОД3 содержат медь в активном центре и цинк как структурный компонент, а СОД2 содержит марганец в активном центре. Гены этих форм локализуются соответственно в хромосомах 21, 6 и 4 (21q22.1, 6q25.3 и 4p15.3-p15.1). Цитозольная СОД1 является небольшим белком с молекулярной массой 32,5 кДа, молекулярная масса митохондриальной СОД2 — около 86-88 кДа. Экстраклеточная СОД3 представляет собой самую крупную супероксиддисмутазу, молекулярная масса — 135 кДа.
Биохимия |
Супероксидный радикал (O2−) спонтанно довольно быстро дисмутирует в кислород O2 и пероксид водорода H2O2 (~105 M−1 s−1 при pH 7). Тем не менее, супероксид ещё быстрее реагирует с некоторыми другими молекулами-мишенями, такими как оксид азота NO, образуя при этом пероксинитрит. Однако, супероксиддисмутаза обладает самой высокой известной каталитической скоростью реакции (~109 M−1 s−1). Реакция лимитирована только частотой столкновения супероксида с ферментом (т. н. диффузионно-лимитированная реакция), благодаря чему супероксиддисмутаза защищает клетку от повреждающего действия супероксида.
Физиология |
Супероксид является одним из основных прооксидантов в клетке, поэтому СОД играет одну из ключевых ролей в антиоксидантной защите организма. Роль этого фермента была показана экспериментально: мыши, у которых отсутствует митохондриальная СОД, выживают лишь несколько дней после рождения, так как у них развивается сильный оксидативный стресс.
Роль в патологии |
Мутации СОД1 у человека могут вызывать амиотрофический латеральный склероз, заболевание моторных нейронов. Механизм развития этого заболевания при этих мутациях, однако, не известен, так как ферментативная активность супероксиддисмутазы при этом не изменяется.
Ссылки |
A.V. Peskin, C.C. Winterbourn (2000). “A microtiter plate assay for superoxide dismutase using a water-soluble tetrazolium salt (WST-1)”. Clinica Chimica Acta. 293: 157—166..mw-parser-output cite.citationfont-style:inherit.mw-parser-output qquotes:"""""""'""'".mw-parser-output code.cs1-codecolor:inherit;background:inherit;border:inherit;padding:inherit.mw-parser-output .cs1-lock-free abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/6/65/Lock-green.svg/9px-Lock-green.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-lock-limited a,.mw-parser-output .cs1-lock-registration abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/d/d6/Lock-gray-alt-2.svg/9px-Lock-gray-alt-2.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-lock-subscription abackground:url("//upload.wikimedia.org/wikipedia/commons/thumb/a/aa/Lock-red-alt-2.svg/9px-Lock-red-alt-2.svg.png")no-repeat;background-position:right .1em center.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registrationcolor:#555.mw-parser-output .cs1-subscription span,.mw-parser-output .cs1-registration spanborder-bottom:1px dotted;cursor:help.mw-parser-output .cs1-hidden-errordisplay:none;font-size:100%.mw-parser-output .cs1-visible-errorfont-size:100%.mw-parser-output .cs1-subscription,.mw-parser-output .cs1-registration,.mw-parser-output .cs1-formatfont-size:95%.mw-parser-output .cs1-kern-left,.mw-parser-output .cs1-kern-wl-leftpadding-left:0.2em.mw-parser-output .cs1-kern-right,.mw-parser-output .cs1-kern-wl-rightpadding-right:0.2em
Campana, F. (2004). “Topical superoxide dismutase reduces post-irradiation breast cancer ibrosis”. J. Cell. Mol. Med. 8 (1): 109—116.
Free text — PDF 333kB- Li, Y.; Huang, T. T.; Carlson, E. J.; Melov, S.; Ursell, P. C.; Olson, J. L.; Noble, L. J.; Yoshimura, M. P.; Berger, C.; Chan, P. H.; et al. Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase. Nat. Genet. 11:376-381; 1995.
- Elchuri, S.; Oberley, T. D.; Qi, W.; Eisenstein, R. S.; Jackson Roberts, L.; Van Remmen, H.; Epstein, C. J.; Huang, T. T. CuZnSOD deficiency leads to persistent and widespread oxidative damage and hepatocarcinogenesis later in life. Oncogene 24:367-380; 2005.
- Muller, F. L.; Song, W.; Liu, Y.; Chaudhuri, A.; Pieke-Dahl, S.; Strong, R.; Huang, T. T.; Epstein, C. J.; Roberts, L. J., 2nd; Csete, M.; Faulkner, J. A.; Van Remmen, H. Absence of CuZn superoxide dismutase leads to elevated oxidative stress and acceleration of age-dependent skeletal muscle atrophy. Free Radic. Biol. Med. 40:1993-2004; 2006.
- Sentman, M. L.; Granstrom, M.; Jakobson, H.; Reaume, A.; Basu, S.; Marklund, S. L. Phenotypes of mice lacking extracellular superoxide dismutase and copper- and zinc-containing superoxide dismutase. J. Biol. Chem. 281:6904-6909; 2006.
См. также |
- Каталаза
- Пероксиредоксины
- Диэтилдитиокарбамат натрия
Ссылки |
OMIM 147450 (SOD1), OMIM 147460 (SOD2), OMIM 185490 (SOD3) and OMIM 105400 (ALS)- Амиотрофический латеральный склероз
- Хороший обзор литературы по СОД.
Damage-Based Theories of Aging Роль супероксиддисмутазы в старении.
Для улучшения этой статьи желательно: |
Категории:
- Гены 21-й хромосомы
- Белки по алфавиту
- Ферменты по алфавиту
- Гены 6-й хромосомы
- Гены 4-й хромосомы
- Антиоксиданты
- Металлопротеины
- КФ 1.15.1
(RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"0.472","walltime":"0.656","ppvisitednodes":"value":3307,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":66306,"limit":2097152,"templateargumentsize":"value":2390,"limit":2097152,"expansiondepth":"value":24,"limit":40,"expensivefunctioncount":"value":11,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":3097,"limit":5000000,"entityaccesscount":"value":10,"limit":400,"timingprofile":["100.00% 585.779 1 -total"," 64.37% 377.074 3 Шаблон:Protein"," 60.85% 356.456 3 Шаблон:Карточка"," 23.95% 140.273 15 Шаблон:Wikidata"," 20.75% 121.529 1 Шаблон:Rq"," 20.01% 117.188 1 Шаблон:Ambox"," 14.18% 83.074 2 Шаблон:Cite_journal"," 11.24% 65.840 16 Шаблон:Rq/"," 10.52% 61.610 1 Шаблон:Rq/sources"," 10.17% 59.575 1 Шаблон:Нет_источника_(сортировка_по_типу)"],"scribunto":"limitreport-timeusage":"value":"0.318","limit":"10.000","limitreport-memusage":"value":3892291,"limit":52428800,"limitreport-logs":"Loaded datatype external-id of P231 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P353 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P267 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P715 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P351 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P354 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P492 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P639 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P352 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P231 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P353 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P267 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P715 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P351 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P354 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P492 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P639 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P352 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P231 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P353 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P267 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P715 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P351 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P354 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P492 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P639 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confignLoaded datatype external-id of P352 from wikidata, consider passing datatype argument to formatProperty call or to Wikidata/confign","cachereport":"origin":"mw1262","timestamp":"20190605173812","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"u0421u0443u043fu0435u0440u043eu043au0441u0438u0434u0434u0438u0441u043cu0443u0442u0430u0437u0430","url":"https://ru.wikipedia.org/wiki/%D0%A1%D1%83%D0%BF%D0%B5%D1%80%D0%BE%D0%BA%D1%81%D0%B8%D0%B4%D0%B4%D0%B8%D1%81%D0%BC%D1%83%D1%82%D0%B0%D0%B7%D0%B0","sameAs":"http://www.wikidata.org/entity/Q410776","mainEntity":"http://www.wikidata.org/entity/Q410776","author":"@type":"Organization","name":"Contributors to Wikimedia projects","publisher":"@type":"Organization","name":"u0424u043eu043du0434 u0412u0438u043au0438u043cu0435u0434u0438u0430","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2007-01-27T14:04:34Z","dateModified":"2018-05-01T13:36:44Z","image":"https://upload.wikimedia.org/wikipedia/commons/0/0b/SOD.gif"(RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":179,"wgHostname":"mw1241"););