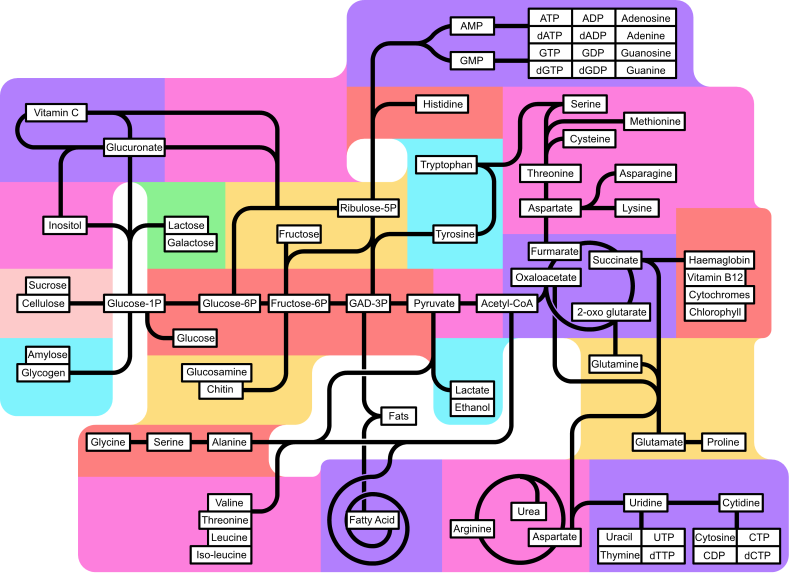
Метаболизам Садржај Кључне биохемикалије Метаболички процеси Енергија Метаболизам азота Метаболизам лекова Термодинамика живих организама Регулација и контрола Еволуција Истраживања Историја Види још Референце Литература Спољашње везе Мени за навигацијуу1GZX1R5ABiochemistry932864910.1016/S0065-2911(08)60018-1„The universal nature of biochemistry”2001PNAS...98..805P333721115855010.1073/pnas.98.3.805„Universality in intermediary metabolism”2004PNAS..10113168S5165431534015310.1073/pnas.04049221011114688310.1006/bulm.2000.0197870309610.1007/BF023388381675649910.1146/annurev.biochem.75.103004.142452„Analysis of tricarboxylic acid-cycle metabolism of hepatoma cells by comparison of 14CO2 ratios”3469066752947„Metabolic fate of the increased yeast amino acid uptake subsequent to catabolite derepression”35756612343141910.1155/2013/461901„A comprehensive classification system for lipids”1572256310.1194/jlr.E400004-JLR200„Nomenclature of Lipids”„Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis”12200891005142510.1042/0264-6021:33805691627865010.1038/nmeth8071619862510.1016/j.jcv.2005.09.00435449010.1146/annurev.bi.47.070178.00512337865510.1111/j.1432-1033.1979.tb12934.x„Catalytic and mechanical cycles in F-ATP synthases: Fourth in the Cycles Review Series”14568931660739710.1038/sj.embor.7400646„The power to reduce: pyridine nucleotides – small molecules with a multitude of functions”17984401729561110.1042/BJ200616381872381„Yeast as a model organism to study transport and homeostasis of alkali metal cations”15119939245259410.1146/annurev.ne.11.030188.0010031692280410.1111/j.1440-1681.2006.04441.x94983591455166010.1007/s00216-003-2219-02003Sci...300..931F1273885010.1126/science.1085049„Mammalian zinc transport, trafficking, and signals”1679376110.1074/jbc.R6000112001719459010.1016/j.tcb.2006.12.003„Metabolizam i faktori koji utiču na brzinu metabolizma - Dijeta.net”„Life: past, present and future”16927131067001410.1098/rstb.1999.05321557313510.1038/nrm1525„Bacterial extracellular zinc-containing metalloproteases”37294083022171496666310.1007/s00253-004-1568-89470654149421610.1177/01486071920160065691044933710.1016/S0955-0674(99)80072-68366068„The cellular fate of glucose and its relevance in type 2 diabetes”1546694110.1210/er.2003-0026оригинала„Pathogen roid rage: Cholesterol utilization by Mycobacterium tuberculosis”42559062461180810.3109/10409238.2014.8957001414448410.1146/annurev.bi.32.070163.002035„Glutamate, at the interface between amino acid and carbohydrate metabolism”10736367„Glutamine: the emperor or his clothes?”11533293635172810.1146/annurev.bi.52.070183.002451„Crassulacean acid metabolism: plastic, fantastic”1188687710.1093/jexbot/53.369.569„Evidence for Autotrophic CO2 Fixation via the Reductive Tricarboxylic Acid Cycle by Members of the ɛ Subdivision of Proteobacteria”10828121583802810.1128/JB.187.9.3020-3027.2005835426910.1111/j.1432-1033.1993.tb18074.x„Life with CO or CO2 and H2 as a source of carbon and energy”1900793989179810.1146/annurev.micro.52.1.1911981RSPTB.293....5B611542310.1098/rstb.1981.0056216275510.2337/diacare.13.6.5821685693510.1111/j.1365-2958.2006.05247.x1681549710.1016/j.nut.2006.04.0081957Natur.179..988K1343076610.1038/179988a0305229010.1146/annurev.bi.57.070188.004033„Concepts and principles of glycobiology”82246061082473410.1080/0968768002944431572681810.1007/s11745-004-1329-91595290310.1146/annurev.biochem.74.082803.1335241501225910.1146/annurev.arplant.48.1.109„An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants”1451736710.1007/BF02703339оригинала1273569510.1039/b109860h„Methanocaldococcus jannaschii Uses a Modified Mevalonate Pathway for Biosynthesis of Isopentenyl Diphosphate”14474421662181110.1128/JB.188.9.3192-3198.20061501220310.1146/annurev.arplant.50.1.47702336710.1146/annurev.bi.50.070181.003101779152910.1007/BF02537824„Complete sequence analysis of the genome of the bacterium Mycoplasma pneumoniae”146264894863310.1093/nar/24.22.4420„The renaissance of aminoacyl-tRNA synthesis”10838891137592810.1093/embo-reports/kve095оригинала„Mechanism of protein biosynthesis”378322489635182833011666978310.1146/annurev.arplant.57.032905.1054211465838010.1078/0176-1617-011692253113810.5483/BMBRep.2012.45.4.259874936210.1016/0959-440X(95)80007-71189351310.1016/S0968-0004(01)02051-5„Energy Transduction: Proton Transfer Through the Respiratory Complexes”26593411675648910.1146/annurev.biochem.75.062003.1017301134005110.1146/annurev.biophys.30.1.23825710210.1146/annurev.mi.47.100193.0020311698093710.1038/nrmicro1490999072510.1111/j.1574-6976.1998.tb00379.x1216542910.1111/j.1574-6976.2002.tb00616.x„Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)”2394588987358„Microbial co-operation in the rhizosphere”1591155510.1093/jxb/eri1971699756210.1016/j.tim.2006.09.001„Hydrogen in metabolism of purple bacteria and prospects of practical application”10.1134/S00262617150101542014316110.1007/s11120-010-9531-2„Diel Variations in Carbon Metabolism by Green Nonsulfur-Like Bacteria in Alkaline Siliceous Hot Spring Microbial Mats from Yellowstone National Park”11689791600081210.1128/AEM.71.7.3978-3986.2005„Interactive Control of Rhodobacter capsulatus Redox-Balancing Systems during Phototrophic Metabolism”1001301159167910.1128/JB.183.21.6344-6354.2001982194910.1016/S0014-5793(98)01245-92004Natur.429..579M1517575610.1038/nature025982939870410.1038/nrmicro.2018.910.1007/s10533-004-0370-0„Cytochrome P450 Homepage”44363003457694088070670218116959861R5A„Identification, characterization and structure of a new Delta class glutathione transferase isoenzyme”11834551571786410.1042/BJ20042015„Toxicology Primer”оригинала1719322410.1002/cbdv.2006901111236988710.2174/13892000233370541146508010.2174/1389200003339171„Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily”12221961169598610.1042/0264-6021:36000011612526210.1016/j.tibtech.2005.08.0021630938610.1111/j.1462-2920.2005.00966.x866038710.1042/bss0610001„Oxidative protein folding in eukaryotes: mechanisms and consequences”21722371475774910.1083/jcb.200311055„Oxidative stress: oxidants and antioxidants”912994310.1113/expphysiol.1997.sp0040241513456510.2174/1381612043384655„The enzymes of detoxication”22499811286965910.1124/pr.55.3.1„The glyoxalase system: new developments towards functional characterization of a metabolic pathway fundamental to biological life”11315222198020„Oxidative stress: oxidants and antioxidants”912994310.1113/expphysiol.1997.sp0040241140993310.1021/tx00025832000Sci...287.1615S1069873110.1126/science.287.5458.1615„Acetonitrile (EHC 154, 1993)”1903935410.1039/b815963g1159307610.1097/00004714-200110000-000082365093210.1517/17425255.2013.796929489250010.1002/9780470122778.ch51289743310.1002/biof.55201701111058136810.1016/S0005-2736(99)00169-875683301726848510.1038/nrd21731048278310.1016/S0005-2728(99)00065-11205000210.1016/S0301-4622(02)00069-8On-Line Biology Bookоригинала„Scale-free networks in cell biology”1625424210.1242/jcs.02714„Regulation analysis of energy metabolism”90502271604593910.1016/j.jtbi.2005.05.0307925313636519710.1007/BF01120819„Physiological control of metabolic flux: the requirement for multisite modulation”113611575754761660005410.1017/S00335835060041361111618510.1016/S0968-0004(00)01712-6173451310.1038/scientificamerican0192-861194993010.2174/1566524024605761„Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1”1111799610.2337/diabetes.49.12.1967„Moonlighting is Mainstream: Paradigm Adjustment Required”2269611210.1002/bies.201100191908475410.1016/0923-2508(96)83998-2988998210.1016/S0065-2911(08)60135-6870684010.1016/0014-5793(96)00631-X„The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture”2007PNAS..104.9358C18904991751759810.1073/pnas.07012141041282640610.1016/S0968-0004(03)00114-2„Network analysis of metabolic enzyme evolution in Escherichia coli”3943131511341310.1186/1471-2105-5-151209525310.1016/S0022-2836(02)00546-6„MANET: tracing evolution of protein architecture in metabolic networks”15596541685423110.1186/1471-2105-7-3511171117410.1016/S0167-7799(01)01813-3„A metabolic network in the evolutionary context: Multiscale structure and modularity”2006PNAS..103.8774S14826541673163010.1073/pnas.05102581031618843410.1016/j.gde.2005.09.0071623000310.1016/j.gde.2005.09.0132006Natur.440..667P1657217010.1038/nature045681081716110.1017/S002966519900124X943954910.1016/S0026-0495(97)90154-21728942410.1016/j.pbi.2007.01.004„From genomes to in silico cells via metabolic networks”1596103610.1016/j.copbio.2005.04.0081661649810.1016/j.tibs.2006.03.007„Global reconstruction of the human metabolic network based on genomic and bibliomic data”2007PNAS..104.1777D17942901726759910.1073/pnas.0610772104„The human disease network”2007PNAS..104.8685G18855631750260110.1073/pnas.0701361104„The implications of human metabolic network topology for disease comorbidity”2008PNAS..105.9880L24813571859944710.1073/pnas.08022081051533122410.1016/j.tibtech.2004.07.00710.1.1.605.89641287405610.1093/bioinformatics/btg177„Hierarchical modularity of nested bow-ties in metabolic networks”15603981691647010.1186/1471-2105-7-3861274984510.1016/S1096-7176(03)00003-X1609593910.1016/j.ymben.2005.06.0011464235510.1016/j.ymben.2003.09.0011170149910.1146/annurev.bioeng.1.1.535„Metabolism”1021382310.1159/000013455A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences859513610.1016/S0167-7799(00)89014-91021383010.1159/000013463„Xenobiotic metabolism: a look from the past to the future”11353742Nobel lecture1125289810.1038/35043073Lehninger principles of biochemistry90164769010.1515/bchm2.1932.210.1-2.33„Metabolism of ketonic acids in animal tissues”12669841674638210.1042/bj0310645634759510.3109/03602538308991399„An enzyme from rat liver catalysing conjugations with glutathione”120568016748905„A new cytochrome in liver microsomes”144820071462534210.1124/dmd.31.12.146114087340On-Line Biology BookоригиналаEcology for gardenersПреглед биохемијеМИТ БиологијаТеме у медицинској биохемијиМедицинска биохемијаГрафикон протока метаболичких путеваSuperCYP: База података о цитохромном метаболизму лековаРеференца метаболичких путеваyThe Nitrogen cycle and Nitrogen fixationууу4057699-1
Метаболизам
грч.хемијских трансформацијаживотензимимаварењеметаболичке путевеензимаспрезањаспонтаним реакцијамакатализаторирегулацијућелијскомсигналехранљивеотровнепрокариотеводоник сулфидметаболичка стопакарбоксилних киселинациклуса лимунске киселинеједноћелијскевишећелијскихслоновиеволуционе историјеефикасностимолекулааминокиселинаугљених хидраталипидамастимаполимереДНКпротеинимакромолекулиПротеиниаминокиселинапептидним везамаензимикатализујуцитоскелетонћелијској сигнализацијиимунском респонсућелијској адхезијиактивном транспортућелијском циклусуКребсов циклусглукозаЛипидибиолошких мембранаћелијска мембранахидрофобниамфифилниорганским растварачимабензенхлороформМастимасних киселинаглицеролаестартриацилглицеридсфингозинсфинголипидимахидрофилнефосфатифосфолипидимаСтероидихолестеролУгљени хидратиалдехидикетонихидроксилнихенергијескробгликогенцелулозахитинмоносахаридимагалактозуфруктозуглукозуполисахаридеДНКРНКнуклеотидарибознудезоксирибозниазотну базутранскрипцијебиосинтезе протеинапоправку ДНКДНК репликацијевирусиРНК геномеХИВреверзну транскрипцијурибозимимасплајсеозомирибозоминуклеотидинуклеобазерибознихетероцикличнипуринипиримидинифункционалних групакоензимимасупстратаденозин трифосфаткатаболизмаанаболизмафосфорилацијеВитаминисхраниНикотинамид аденин динуклеотидниацинадехидрогеназаредукујуредуктазанатријумкалијумугљениказоткалцијумнатријумхлоркалијумводоникфосфоркисеониксумпорОрганска једињењајонскиелектролитинатријумкалијумкалцијуммагнезијумхлорфосфорбикарбонатјонских градијенатаћелијске мембранеосмотски притисакpHнервамишићаакциони потенцијалиекстрацелуларног флуидацитозолајонски каналиконтракција мишићаТ-тубуламаПрелазни металимикроелементицинкгвожђекофакторикаталазехемоглобинферитинметалотионеинметаболичке путевеензиматермодинамичкикатализаториотровипрокариотиводоник сулфидкарбоксилна киселинациклусу лимунске киселинебактеријаслонБазални метаболизамКатаболизамугљеникорганотрофни организмилитотрофни организмифототрофни организмиредокс реакцијаелектронаводаамонијакводоник сулфидгвожђанитратсулфаторганске молекулеугљен-диоксидфотосинтетичкихмодрозелене бактеријепротеиниполисахаридилипидиацетил коензима Ациклусу лимунске киселинеланцу електронског транспортаникотинамид аденин динуклеотидаскробцелулозадигестивни ензимипротеазегликозидне хидролаземоносахаридицревимажелудацгуштерачупљувачне жлездеактивног транспортамоносахаридагликолизаглукозафруктозапируватацетил-КоАциклус лимунске киселинеугљен-диоксидлактатлактатна дехидрогеназапентозно фосфатни путNADPHпентознирибозануклеинских киселинахидролизебета оксидацијехолестеролАминокиселинеуреетрансаминазециклус урејекетокиселинаглутаматакетоглутаратГлукогене аминокиселинеглуконеогенезеАнаболизамћелијскеаминокиселинемоносахаридиисопреноидинуклеотидиATPпротеиниполисахаридилипидинуклеинске киселинеугљен-диоксидафотосинтезаугљен-диоксидамодрозеленим бактеријамафотосинтетичких реакционих центараглицерат 3-фосфатрибулоза-бисфосфатна карбоксилазаКалвин – Бенсоновог циклусаC3 угљенична фиксацијаC4 угљенична фиксацијаCAM фотосинтезапрокариотареверзног Кребсог циклусахемоаутотрофимоносахаридеглукозаполисахаридаскробглукозепируватлактатглицеролглицерат 3-фосфатаминокиселинеглуконеогенезаглукоза 6-фосфатагликолизомгликолизасупстратномкичмењакамасне киселинеглуконеогенезепируваткетонска телаглиоксилатни циклусдекарбоксилациониоксалоацетатагликанигликозилтрансферазеуридин-дифосфат глукозахидроксилнуолигосахарилтрансфераземасно киселинских синтазадехидрираалкенскеалканскепластидимаТерпениизопреноидикаротеноидеприродних производаизопренскихизопентенил пирофосфатадиметилалил пирофосфатаархејамевалонатним путемнемевалонатниглицералдехид 3-фосфатбиосинтеза стероидаскваленланостеролахолестеролергостеролпротеиногених аминокиселинаесенцијалних аминокиселинапаразитимаглутаматглутаминтрансаминисанапептидних везапримарна структуратранспортне РНКестарскеATPаминоацил тРНК синтетазерибозоминформационој РНКмравље киселинеПурининуклеозидирубозуАденингванининозинглицинаглутаминааспартинске киселинеформатакоензиматетрахидрофолатаПиримидиниоротатаоксидативне фосфорилацијеелектрониКребсов циклусATPеукариотамитохондријапротонареспираторни ланацелектрохемијски градијентATP синтазаATPАДПпрокариотаунутрашњој мембраниредукованихкисеоникпротонапрокариотанеорганских једињењаводониксумпорсулфидводоник сулфидтиосулфатгвожђе(II)-оксидамонијакнитритабиогеохемијским циклусимаацетогенезанитрификацијаденитрификацијаплодност земљиштабиљкебактеријамодрозелене бактеријепурпурне бактеријезелене сумпорне бактеријепротистифотосинтезефотосинтетички реакциони центриродопсинифотосинтетског пигментафотосистем IIцитохром б6ф комплексатилакоиднухлоропластимафотосистем IКалвиновом циклусуАзотниазотног циклусаАзотни циклусбиогеохемијски циклусазотатмосфереземљиштаморског екосистемафиксацијаамонификацијанитрификацијаденитрификацијаземљине атмосфереазотанедостатакаекосистемаекологијупримарну продукцијудекомпозицијупромениле глобални азотни циклуслековаорганизмимаензиматскихметаболичких путеваксенобиотикалековиотровибиотрансформациједетоксикацијефармакокинетикомсинтетички лековиприродни отровиантибиотицицитохром П450 оксидазеUDP-глукуронозилтрансферазеглутатион S-трансферазеекологијибиодеградацијибиоремедијацијиперзистентне органске загађивачеорганохлориднааеробне организмеоксидативни стресоксидативна фосфорилацијудисулфидних везапротеинског савијањареактивне врсте кисеоникаводоник пероксидантиоксиданснихглутатионкаталазепероксидазефармацеутских лековафармакологијемедицинеотпорност на вишеструке лековеинфективних болестихемотерапијуканцерасупстратиинхибиториинтеракција лекованауци о животној срединимикроорганизамабиоремедијацијеглутатион S-трансферазепестицидехербицидеметаболизмуензиматскихћелијске мембранетранспортним протеинимахидрофилниххидрофобнихлипидимаполарниглиоксалазни системалдехидреактивне врсте кисеоникацитохрома П-450угљоводоникеоксидацијуредукцијухидролизуциклизацијудециклизацијуцитохром П450фенотиазинепарацетамолендогенисупстратпролектоксификацијаацетонитрилформалдехидводоник цијанидбиомиметичкетримебутинаформалдехидакисеоникусупероксидни анјонконјугованиглутатионсулфатглицинглукуронска киселинакарбоксилхидроксиламиносулфхидрилактивне метаболитеелектрофилеглутатион S-трансферазеацетилцистеинскихγ-глутаматниглицинскигама глутамил трансферазедипептидазацистинскиацетилисанпротеина за резистенцију на више лијековаATP-везујућих касетних транспортерапероксидиалдехидиглиоксалазни системметилглиоксалантиоксидансниреактивне врсте кисеоникаглатки ендоплазматични ретикулумјетребиолошко ткивогастроинтестиналном трактупорталну венуепителско ткивогастроинтестиналног трактаплућабубрегекожуСистем цитохром П450 монооксигеназеензимска индукцијаензимска инхибицијафармакогенетикаентерохепатичка циркулацијаисхранаинтестинална флораполне разликефеталнихнеонаталнихстарихљудиживотињаодраслихполиморфизамКанадисистема цитохромне П450 монооксигеназејетребубрегасрцазаконима термодинамикерадаДруги принцип термодинамикезатвореном системуентропијеотворени системиеквилибријумудисипативни системиспонтаних процесатермодинамичкомхемијске термодинамикебиологијибиохемијипрви принцип термодинамикедруги принцип термодинамикеГибсову слободну енергијустатистичку термодинамикуреакциону кинетикуГибсове слободне енергијеАлфред ЛоткаПланкова константарегулисанехомеостазафлуксалостерну регулацијухормонифактори растарецепторисистема секундарних гласникафосфорилацијуинсулинанивоа крвне глукозеинсулинске рецепторепротеинских киназагликогенфосфорилазегликогенске синтазепротеинске фосфатазепросторној структуриефекторскокатализиреакцијекооперацијукватернарнимаконитазацитратаизоцитратIRPF1иРНКпротеина који везују гвожђефосфатиметилуридинаденинаденозин дифосфат рибозилфосфорилацијаСеринтреонинтирозинКиназефосфатазетри доменазадњег универзалног заједничког преткапрокариотскаметаногенаеволуцијепуринскогРНК светаMANETпаразитимадомаћинаендосимбиотскихредукционистичкирадиоактивних обележивачапречишћеникинетикаинхибитореметаболомметаболичке мрежехолистичкиизражавањима генапротеомскихДНК микрочиповаанализи мрежа„лептир машне”метаболички инжењерингквасацбактеријебиотехнолошкимлековаантибиотици1,3-пропандиолшикиминска киселинагрчке речиАристотеловњеговомкласичног елементаИбн ал-НафисаСанторио Санториовитална силаалкохолног врењаквасацаЛуј ПастерФридриха ВелераурееbenzaldehиdметилацијаацетилацијасулфонацијаензимаЕдуард БухнербиохемијеХанса Кребсациклус урееХансом Корнбергомхроматографиједифракције x-зракаНМР спектроскопијерадиоизотопног означавањаелектронске микроскопијемолекуларно динамичкихРичарда Вилијамаглутатион S-трансферазаММЕТмтауyнхргцпифслометауунхргцпифсломепонА16Ц10аурyнхргцпифсоетММЕТмтауyнхргцпифслометауунхргцпифсломепонА16Ц10аурyнхргцпифсоет
Метаболизам
Иди на навигацију
Иди на претрагу
| Биохемија |
|---|
 |
Кључне компоненте |
|
Историја и теме |
|
|
|
Портали: Биологија, Хемија, MCB |
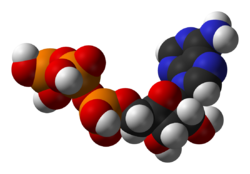
Структура аденозин трифосфата (ATP), централног интермедијера у енергијском метаболизму
Метаболизам (грч. μεταβολήσμός што значи промена) је биохемијски процес у коме долази до модификације хемијских једињења у живим организмима и ћелијама. Метаболизам се дели на анаболизам односно биосинтезу (стварање) комплексних органских молекула и на катаболизам који је обрнути процес од анаболизма, а то је раздвајање комплексних органских једињења у једноставнија једињења. Свеукупни биохемијски процеси у једном организму се речју називају метаболизам. Без метаболизма живи организми не би могли да постоје.[1]
Метаболизам је сет хемијских трансформација којима се одржава живот у ћелијама. Ове реакције су катализоване ензимима. Оне омогућавају организмима да расту и да се репродукују, одрже своје структуре, и да одговарају на стимулусе из околине. Реч метаболизам се исто тако може односити на све хемијске реакције које се одвијају у живим организмима, укључујућу варење и транспорт супстанци између различитх ћелија, у ком случају се сет реакција унутар ћелија назива интермедијерни метаболизам.
Хемијске реакције метаболизма су организоване у метаболичке путеве, у којима се једна хемикалија трансформише путем серије корака у другу хемикалију, посредством секвенце ензима. Ензими су од пресудног значаја за метаболизам, зато што они омогућавају организмима одвијање жељених реакција са високом енергијом активације које се не би спонтано одвијале. То се обично остварује путем спрезања тих реакција са спонтаним реакцијама у којима се отпушта енергија. Ензими делују као катализатори који омогућавају реакцијама да брже теку. Ензими исто тако омогућавају регулацију метаболичких путева у одговору на промене у ћелијском окружењу или на сигнале из других ћелија.
Метаболички систем датог организма одређује које супстанце ће бити хранљиве, а које ће бити отровне. На пример, неке прокариоте користе водоник сулфид као нутријент, док је тај гас отрован за животиње.[2] Брзина метаболизма, метаболичка стопа, утиче на количину хране која је неопходна организму, а исто тако утиче и на начин на који организам долази до хране.
Упадљива одлика метаболизма је сличност основних метаболичких путева и њихових компоненти, чак и између веома различитих врста.[3] На пример, група карбоксилних киселина које су најбоље познате као интермедиери циклуса лимунске киселине је присутна у свим познатим организмима, од једноћелијске бактерије Escherichia coli до огромних вишећелијских организама, као што су слонови.[4] Те упадљиве сличности метаболичких путева су вероватно последица њихове ране појаве током еволуционе историје, и задржавања услед њихове ефикасности.[5][6]
Садржај
1 Кључне биохемикалије
1.1 Аминокиселине и протеини
1.2 Липиди
1.3 Угљени хидрати
1.4 Нуклеотиди
1.5 Коензими
1.6 Минерали и кофактори
2 Метаболички процеси
2.1 Катаболизам
2.1.1 Варење
2.1.2 Енергија из органских једињења
2.2 Анаболизам
2.2.1 Фиксација угљеника
2.2.2 Угљени хидрати и гликани
2.2.3 Масне киселине, изопреноиди и стероиди
2.2.4 Протеини
2.2.5 Нуклеотидна синтеза и спасавање
3 Енергија
3.1 Оксидацијска фосфорилација
3.2 Енергија из неорганских једињења
3.3 Енергија сунчеве светлости
4 Метаболизам азота
5 Метаболизам лекова
5.1 Пермеабилносне баријере и детоксификација
5.2 Фазе детоксификације
5.2.1 Фаза I – модификација
5.2.2 Фаза II – конјугација
5.2.3 Фаза III – даље модификације и екскреција
5.3 Ендогени токсини
5.4 Локације
5.5 Фактори који утичу на метаболизам лекова
6 Термодинамика живих организама
6.1 Енергија трансформације у биолошким системима
7 Регулација и контрола
7.1 Алостерни ензими
7.2 Ковалентно модулисани ензими
8 Еволуција
9 Истраживања
10 Историја
11 Види још
12 Референце
13 Литература
14 Спољашње везе
Кључне биохемикалије

Структура триацилглицеролног липида
Већина структура од којих се састоје животиње, биљке и микроби су направљене од три основне класе молекула: аминокиселина, угљених хидрата и липида (који се често називају мастима). Пошто су ти молекули витални за живот, метаболичке реакције су усредсређене било на прављење тих молекула током конструкције ћелија и ткива, или на њихово разлагање, при чему се они користе као извори енергије, путем варења. Те биохемикалије могу да буду спојене у полимере као што су ДНК и протеини, есенцијални макромолекули живота.
| Тип молекула | Име мономерних форми | Име полимерних форми | Примери полимерних форми |
|---|---|---|---|
Аминокиселине | Аминокиселине | Протеини (такође познати као полипептиди) | Фиброзни протеини и глобуларни протеини |
Угљени хидрати | Моносахариди | Полисахариди | Скроб, гликоген и целулоза |
Нуклеинске киселине | Нуклеотиди | Полинуклеотиди | ДНК и РНК |
Аминокиселине и протеини
Протеини се састоје од аминокиселина уређених у линеарне ланце спојене пептидним везама. Многи протеини су ензими који катализују хемијске реакције метаболизма. Други протеини имају структурне и механичке функције, као што су они који формирају цитоскелетон, систем којим се одржава ћелијски облик.[7] Протеини су исто тако важни у ћелијској сигнализацији, имунском респонсу, ћелијској адхезији, активном транспорту кроз мембране, и ћелијском циклусу.[8] Аминокиселине такође доприносе ћелијском енергетском метаболизму, тако што служе као извор угљеника на улазу у цилус лимунске киселине (Кребсов циклус),[9] што је посебно значајно кад су оне примарни извори енергије, као што случај кад је глукоза оскудна, или кад ћелије подлежу метаболичком стресу.[10]
Липиди
Липиди су најразноврснија група биохемикалија. Њихова главна структурна улага је да су компонента биолошких мембрана, унутрашњих и спољашњих, као што је ћелијска мембрана. Они су исто тако значајан извор енергије.[8] Липиди се обично дефинишу као хидрофобни или амфифилни биолошки молекули, мада се растварају у органским растварачима као што је бензен или хлороформ.[11]Масти су група великих молекула који се састоје од масних киселина и глицерола; молекул глицерола везан за три масне киселине је естар који се зове триацилглицерид.[12] Постоји неколико варијација ове основне структуре, укључујући алтернативне основе као што је сфингозин у сфинголипидима, и хидрофилне групе као што су фосфати у фосфолипидима. Стероиди, као што је холестерол, су још једна важна класа липида.[13]
Угљени хидрати

Глукоза може да постоји као отворен ланац и као прстен.
Угљени хидрати су алдехиди или кетони, са неколико везаних хидроксилних група, који могу да постоје као отворени ланци или прстенови. Угљени хидрати су најраспрострањенији биолошки молекули. Они врше бројне улоге, као што је складиштење и транспорт енергије (скроб, гликоген) и као структурне компоненте (целулоза у биљкама, хитин код животиња).[8] Основне угљено хидратне јединице се називају моносахаридима и обухватају између осталих галактозу, фруктозу, и глукозу. Моносахариди могу да буду повезани у полисахариде на скоро неограничен број начина.[14]
Нуклеотиди
Две нуклеинске киселине, ДНК и РНК, су полимери нуклеотида. Сваки нуклеотид се састоји од фосфата везаног за рибозну или дезоксирибозни шећерну групу, која је везана за азотну базу. Нуклеинске киселине су критичне за чување и употребу генетичке информације, и њену интерпретацију путем процеса транскрипције и биосинтезе протеина.[8] Та информација је заштићена путем механизма за поправку ДНК и пропагира се путем ДНК репликације. Многи вируси имају РНК геноме, на пример ХИВ. Они користе реверзну транскрипцију за креирање ДНК шаблона из свог виралног РНК генома.[15] РНК у рибозимима као што су сплајсеозоми и рибозоми је слична са ензимама у смислу да може да катализује хемијске реакције. Индивидуални нуклеотиди су формирани везивањем нуклеобазе за рибозни шећер. Те базе су хетероциклични прстенови који садрже азот. Они се класификују као пурини или пиримидини. Нуклеотиди исто тако делују као коензими у реакцијама трансфера метаболичких група.[16]
Коензими

Структура коензима ацетил-КоА. Преносива ацетил гурпа је везана за атом сумпора, на левој страни структуре.
Метаболизам обухвата широк низ хемијских реакција. Већина њих се може груписати у неколико основних типова реакција које обухватају трансфер функционалних група атома и њихових веза унутар молекула.[17] Та заједничка хемија омогућава ћелијама да користе малу групу метаболичких интермедијера да преносе хемијске групе између различитих реакција.[16] Ти интермедијери који преносе групе се називају коензимима. Свака класа реакција преноса група се изводи посредством специфичног коензима, који је супстрат за групу ензима који га производе, и за групу ензима који га конзумирају. Ти коензими се стога стално формирају, конзумирају и затим рециклирају.[18]
Један централни коензим је аденозин трифосфат (ATP), који је универзална енергијска валута у ћелијама. Тај нуклеотид се користи за трансфер хемијске енергије између различитих хемијских реакција. Постоји релативно мала количина ATP молекула у ћелијама, али се они константно регенеришу, људско тело може да употреби еквивалент своје тежине ATP молекула на дан.[18] ATP делује као мост између катаболизма и анаболизма. Катаболизмом се разлажу молекули, а анаболизмом се формирају. Катаболичке реакције генеришу ATP, а анаболичке реакције га конзумирају. ATP такође служи као преносник фосфатне групе у реакцијама фосфорилације.

Структура хемоглобина. Протеинске подјединице су обојене црвено и плаво, а хем група која садржи гвожђе зелено. Приказ је базиран на PDB: 1GZX.
Витамин је органско једињење које је неопходно у малим количинама и које се не може формирати у ћелијама датог организма. У људској исхрани, витамини већином функционишу као коензими након модификације; на пример, сви у води растворни витамини су фосфорилисани или су спрегнути са нуклеотидима кад се користе у ћелијама.[19]Никотинамид аденин динуклеотид NAD+), дериват витамина B3 (ниацина), важан је коензим који делује као акцептор водоника. Стотине различитих типова дехидрогеназа уклањају електроне са својих субстрата и редукују NAD+ до NADH. Том редукцијом се формира коензим је затим супстрат за било коју од редуктаза у ћелији, које редујукују своје супстрате.[20] Никотинамид аденин динуклеотид постоји у две сродне форме у ћелији, NADH и NADPH. NAD+/NADH форма је важнија у катаболичким реакцијама, док се NADP+/NADPH користи у анаболичким реакцијама.
Минерали и кофактори
Неоргански елементи играју критичне улоге у метаболизму; неки су изобилно заступљени (е.г. натријум и калијум), док други функционишу у веома малим концентрацијама. Око 99% масе сисара се састоји од елемената угљеник, азот, калцијум, натријум, хлор, калијум, водоник, фосфор, кисеоник и сумпор.[21]Органска једињења (протеини, липиди и угљени хидрати) садрже највећи део угљеника и азота; највећи део кисеоника и водоника је присутан у облику воде.[21]
Изобилни неоргански елементи делују као јонски електролити. Најважнији јони су натријум, калијум, калцијум, магнезијум, хлор, фосфор и органски јон бикарбонат. Одржавањем прецизних јонских градијената кроз ћелијске мембране одржава се осмотски притисак и pH.[22] Јони су такође критични за функцију нерва и мишића, пошто се акциони потенцијали у тим ткивима производе разменом електролита између екстрацелуларног флуида и ћелијског флуида, цитозола.[23] Електролити улазе и напуштају живе ћелије посредством протеина у ћелијској мембрани званих јонски канали. На пример, контракција мишића је зависна од кретања калцијума, натријума и калијума кроз јонске канале у ћелијској мембрани и Т-тубулама.[24]
Прелазни метали су обично присутни као микроелементи организмима, при чему су цинк и гвожђе најзаступљенији међу њима.[25][26] Ти метали се користе у појединим протеинима као кофактори и есенцијални су за активност ензима, као што су каталазе, и протеина који преносе кисеоник, као што је хемоглобин.[27] Метални кофактори су снажно везани за специфична места у протеинима; мада ензимски кофактори могу да буду модификовани током катализе, они се увек враћају у своје почетно стање на крају каталитичке реакције. Метални микронутриенти се уносе у организме посредством специфичних транспортера и везују се за складишне протеине, као што је феритин или металотионеин, кад се не користе.[28][29]
Метаболички процеси
Метаболички процеси омогућују организму да расте, да се размножава, да одржава своју структуру и реагује на околину. Према метаболичким реакцијама, метаболизам се дели у две категорије:
Катаболизам којим се разграђује органска материја (нпр. накупљање енергије ћелијским дисањем)
Анаболизам који користи енергију за изградњу ћелијских делова (биосинтеза органске материје) као што су нпр. протеини и нуклеинске киселине.
Хемијске реакције метаболизма су подељене у метаболичке путеве у којима се одређено хемијско једињење претвара у нека друга уз помоћ ензима. Ензими су кључни у метаболизму зато што омогућују организму да брзо и ефикасно изводи биолошки пожељне, али термодинамички неповољне хемијске реакције, у којима ензими делују као катализатори. Ензими омогућују и контролу метаболичких путева, као одговор на промене у ћелијској околини или неки други подражај.
Неки од основних метаболичких путева у организму човека су:
- Метаболизам воде
- Метаболизам аминокиселина, које се међусобно повезују пептидном везом и обликују полипептиде тј. протеине
- Метаболизам угљених хидрата
- Метаболизам масти
Метаболизам појединог организма одређује која ће се хемијска једињења користити као храњиве материја, а која ће бити отрови. Тако на пример, неки прокариоти користе водоник сулфид, као хранљиву материју, док је то једињење за већину животиња отровно. Изненађујућа је сличност основних метаболичких путева међу великим бројем врста. Тако на пример карбоксилна киселина, међупродукт у циклусу лимунске киселине, је присутна у свим организмима, од бактерија, као што је Escherichia coli, па до великих вишећелијских организама, нпр. слон.
Базални метаболизам је назив за количину енергије која је потребна за одржавање основних животних функција организма. У разговорима о дијетама и одржавању линије, стално се јавља теза да постоје људи који имају „метаболизам да им се ништа не задржава, колико год да једу“ и о онима „којима се гоје и кад прођу поред хране“. Тачно је да индивидуалне разлике постоје, али постоје и промене које једна особа може сама на различите начине (свесно или несвесно) да индукује у свом телу. Колико је „брз метаболизам“, односно колико један организам троши у стању мировања у току дана изражава се БМР бројем, односно бројем калорија које троши базални метаболизам.[30]
Катаболизам
Катаболизам је група метаболичких процеса који разграђују велике сложене молекуле. Главна сврха разградње сложених молекула је добијање мањих молекула који касније служе као „материјал“ за изградњу сложених једињења за потребе организма (анаболичке реакције), као и добијање енергије. Катаболичке реакције се разликују од организма до организма, па се према начину на који организми добивају енергију и угљеник могу и поделити. Организми који користе органске молекуле као извор енергије називају се органотрофни организми, док литотрофни организми користе неорганска једињења, а фототрофни организми сунчеву светлост користе као потенцијални извор хемијске енергије.
Целуларна респирација је процес стварање енергије (ATP и NADPH). Овај процес је такође активан и при варењу хране.
Катаболизам угљених хидрата
Гликогенолиза процес разградње гликогена до глукозе
Гликолиза процес разградње глукозе до пирувата уз продукцију ATP, при чему кисеоник није потребан
Ембден-Мејерхофов метаболизам, најчешћи метаболизам у процесу гликолизе
Ентнер-Доудорофов метаболизам споредни процес гликолизе који се јавља код неких бактерија
Метаболизам фосфатне пентозе је процес у коме се синтетише NADPH из глукозе
Катаболизам протеина је процес у коме се протеини хидролизом претварају у амино киселине
Аеробна респирација- Ланац транспорта електрона
- Оксидативна фосфорилација
Анаеробна респирација- Коријев циклус
- Ферментација млечне киселине
- Ферментација
- Ферментација етанола
Сви ови различити облици метаболизма зависе од редокс реакција које обухватају пренос електрона с редукованог молекула донора (нпр. органски молекули, вода, амонијак, водоник сулфид, или јон гвожђа), на молекул акцептора електрона (нпр. кисеоник, нитрат или сулфат).[31] Код животиња, ове реакције обухватају комплексне органске молекуле, који се разлажу до једноставнијих молекула, као што су угљен-диоксид и вода. Код фотосинтетичких организама, као што су биљке и модрозелене бактерије, ове реакције електронског трансфера не ослобађају енергију, него се користе као начин складиштења енергије апсорбоване из сунчевог светла.[32]
Класификација организама према њиховом метаболизму
| ||||||||||||||||||||||
Најчешћи скуп катаболичких реакција код животиња може се раздвојити у три главне фазе. У првој фази се велики молекули, као што су протеини, полисахариди или липиди, варе до мањих компоненти изван ћелија. Затим те мање молекуле преузимају ћелије и конвертују их до малих молекула, обично ацетил коензима А (ацетил-КоА), чиме се ослобаћа део енергије. На крају се ацетил група на КоА оксидује до воде и угљен-диоксида у циклусу лимунске киселине и ланцу електронског транспорта, чиме се ослобађа ускладиштена енергија путем редукције коензима никотинамид аденин динуклеотида (NAD+) до NADH.
Варење
Макромолекуле, као што су скроб, целулоза или протеини, ћелије не могу брзо да преузму и они морају да буду разложени у мање јединице пре него што се могу користиту у хелијском метаболизму. Неколико устаљених класа ензима вари ове полимере. Ови дигестивни ензими обухватају протеазе, које варе протеине до аминокиселина, као и гликозидне хидролазе које варе полисахариде до једноставних шећера познатих као моносахариди.
Микроби јеноставно излучују дигестивне ензиме у своје окружење,[33][34] док животиње једино излучују те ензиме из специјализованих ћелија у својим цревима, укључујући желудац и гуштерачу, и пљувачне жлезде.[35] Аминокиселине или шећери ослобођени помоћу тих екстрацелуларних ензима затим бивају упумпани у ћелије помоћу протеина активног транспорта.[36][37]
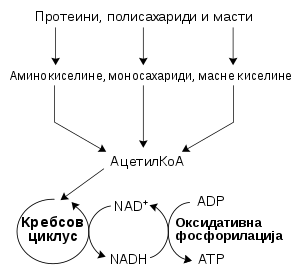
Поједностављени приказ катаболизма протеина, угљених хидрата и масти
Енергија из органских једињења
Катаболизам угљених хидрата је разлагање угљених хидрата у мање јединице. Угљени хидрати обично бивају унети у ћелије након што су сварени до моносахарида.[38] Унутар ћелије, главни пут разлагања је гликолиза, при чему се шећери као што су глукоза и фруктоза конвертују у пируват и делом се формира ATP.[39] Пируват је интермедијер у неколико метаболичких путева, мада се највећи део конвертује у ацетил-КоА путем аеробне (кисеоничне) гликолизе и улази у циклус лимунске киселине. Извесна количина ATP формира у Кребсовом циклусу. Најважнији продукат је NADH, који настаје из NAD+ при оксидацији ацетил-КоА. Овом оксидацијом се ослобађа угљен-диоксид као отпадни продукат. У анаеробним условима, гликолизом се производи лактат, путем ензима лактатна дехидрогеназа који поново оксидује NADH до NAD+ ради поновне употребе у гликолизи. Једна алтернативна рута за разлагање глукозе је пентозно фосфатни пут, којим се редукује коензим NADPH и формирају пентозни шећери као што је рибоза, шећерна компонента нуклеинских киселина.
Масти се катаболизују путем хидролизе до слободних масних киселина и глицерола. Глицерол даље подлеже гликолизи, а масне киселине се разлажу путем бета оксидације уз формирање ацетил-КоА, који затим улази у циклус лимунске киселине. Масне киселине ослобађају више енергије при оксидацији од угљених хидрата, зато што угљени хидрати имају већи садржај кисеоника у својој структури. Стероиде исто тако разлажу неке бактерије у процесу који је сличан бета оксидацији, и при том процесу разлагања се ослобађају знатне количине ацетил-КоА, пропионил-КоА, и пирувата, сви од којих се могу користити у ћелији као извор енергије. M. tuberculosis може да расте на липиду холестерол као једином извору угљеника, и за гене који учествују у путевима употребе холестерола је утврђено да су важни током различитих фаза животног циклуса инфекције са M. tuberculosis.[40]
Аминокиселине се користе за синтезу протеина и других биомолекула, или бивају оксидоване до урее и угљен-диоксида као извор енергије.[41] Оксидациони пут почиње са уклањањем амино групе посредством трансаминазе. Амино група улази у циклус уреје, остављајући деаминовани угљенични костур у облику кетокиселина. Неке од тих кетокиселина су интермедијери у циклусу лимунске киселине, на пример деаминацијом глутамата се формира кетокиселина α-кетоглутарат.[42]Глукогене аминокиселине исто тако могу да буду конвертоване у глукозу, путем глуконеогенезе.[43]
Анаболизам
Анаболизам је процес стварања комплексних једињења од једноставних органских молекула:
- Гликогенеза
- Глуконеогенеза
- Синтеза порфирина
HMG-CoA редукција, у којој се ствара холестерол и изопреноиди.
Секундардни метаболизам, метаболизам који није неопходан за раст, преживљавање и репродукцију, али има еколошких функција.
Фотосинтеза
Светла фаза фотосинтезе (реакције које зависе од одређене количине светлости)
Тамна фаза (не зависе од светлости)- Калвинов циклус
- Фиксација угљеника
Анаболизам је низ метаболичких процеса изградње сложених молекула, у којима се користе прекурсори и енергија настала катаболизмом. Сложени молекули који највећим делом чине ћелијске структуре, настају поступно, корак по корак из малих једноставних молекула. Анаболизам се одвија у три основна ступња. У првом ступњу настају прекурсори сложених молекула као што су аминокиселине, моносахариди, исопреноиди и нуклеотиди. У другом ступњу прекурсори се активирају, везањем енергије из ATP молекула, а у трећем ступњу се прекурсори спајају у сложена једињења као што су протеини, полисахариди, липиди и нуклеинске киселине.
Организми се међусобно разликују по томе колико молекула могу да изграде у својим ћелијама. Аутотрофни организми као што су биљке могу да изграде сложене молекуле као што су полисахариди и протеини из једноставних молекула попут угљен-диоксида и воде (фотосинтеза). За разлику од њих, хетеротрофним организмима су потребни извори сложенијих молекула, као што су аминокиселине и моносахариди, како би изградили своје сложене молекуле. Организми се могу даље поделити на фотоаутотрофне и фотохетеротрофне, чији је извор енергије Сунце, и на хемоаутотрофне и хемохетеротрофне, чији је извор енергије реакција оксидације неорганских материја.
Фиксација угљеника
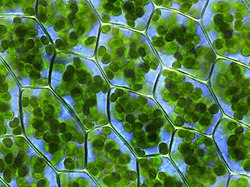
Биљне ћелије (омеђене љубичастим зидовима) испуљене хлоропластима (зелено), који су места фотосинтезе
Фотосинтеза је синтеза угљених хидрата из сунчеве светлости и угљен-диоксида (CO2). У биљкама, модрозеленим бактеријама и алгама, кисеонична фотосинтеза разлаже воду, и при томе настаје кисеоник као отпадни продукат. Овај процес користи ATP и NADPH, који су формирани путем фотосинтетичких реакционих центара, за конвертовање CO2 у глицерат 3-фосфат, који се затим може конвертовати у глукозу. Ова реакција фиксације угљеника се изводи посредством ензима рибулоза-бисфосфатна карбоксилаза као део Калвин – Бенсоновог циклуса.[44] Три типа фотосинтезе се одвијају у биљкама, C3 угљенична фиксација, C4 угљенична фиксација и CAM фотосинтеза. Они се разликују по рути коју угљен-диоксид узима у Калвиновом циклусу, при чему C3 биљке директно фиксирају CO2, док при C4 и CAM фотосинтези прво долази до инкорпорације CO2 у друга једињења, као адаптација на интензивну сунчеву светлост и сушне услове.[45]
Код фотосинтетичких прокариота механизми угљеничне фиксације су разноврснији. Овде, угљен-диоксид може да буде фиксиран путем Калвин – Бенсоновог циклуса, реверзног Кребсог циклуса,[46] или карбоксилације ацетил-КоА.[47][48] Прокариотски хемоаутотрофи исто тако фиксирају CO2 путем Калвин – Бенсоновог циклуса, али користе енергију из неорганских једињења за вођење реакције.[49]
Угљени хидрати и гликани
У анаболизму угљених хидрата, једноставне органске киселине се могу конвертовати у моносахариде, као што је глукоза, који се затим користе за формирање полисахарида, као што је скроб. Стварање глукозе из једињења као што је пируват, лактат, глицерол, глицерат 3-фосфат и аминокиселине се назива глуконеогенеза. Глуконеогенезом се конвертује пируват до глукоза 6-фосфата путем серије интермедијера, многи од којих су заједнички са гликолизом.[39] Међутим, овај метаболички пут није једноставно гликолиза која се одвија уназад, пошто је неколико корака катализовано негликолитичким ензимима. Ово је важно, јер се тиме омогућава засебна регулација формирања и разлагања глукозе, и спречавају ситуације у којима се оба метаболичка пута симултано одвијају у супстратном (бескорисном) циклусу.[50][51]
Иако је стварање масти уобичајени начин чувања енергије код кичмењака, као што су људи, масне киселине у тим оставама не могу да буду конвертоване до глукозе путем глуконеогенезе, пошто ти организми не могу да конвертују ацетил-КоА у пируват; биљке имају ту способност, док животиње немају неопходну ензиматску машинерију.[52] Консеквентно, након дуготрајног гладовања, кичмењаци морају да производе кетонска тела из масних киселина да би надокнадили глукозу у ткивима као што је мозак, која не могу да метаболизују масне киселине.[53] У другим организмима, као што су биљке и бактерије, овај метаболички проблем је решен користећи глиоксилатни циклус, којим се заобилази декарбоксилациони корак у циклусу лимунске киселине и омогућава трансформација ацетил-КоА до оксалоацетата, који се затим може користити за продукцију глукозе.[52][54]
Полисахариди и гликани настају секвенцијалним додавањем моносахарида посредством гликозилтрансферазе из реактивних шећерно-фосфатних донора, као што је уридин-дифосфат глукоза (UDP-глукоза), на акцепторску хидроксилну групу растућег полисахарида. Како било која хидроксилна група на прстену супстрата може да буде акцептор, формирани полисахариди могу да имају праволанчане или разгранате структуре.[55] Настали полисахариди могу да имају структурне и метаболичке функције, или могу да буду повезани са липидима и протеинима посредством ензима званих олигосахарилтрансферазе.[56][57]
Масне киселине, изопреноиди и стероиди
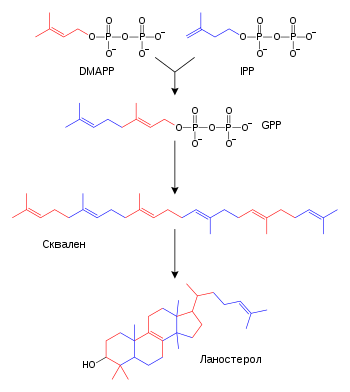
Поједностављена верзија пута стероидне синтезе са приказаним интермедијерима изопентенил пирофосфат (IPP), диметилалил пирофосфат (DMAPP), геранил пирофосфат (GPP) и сквален. Неки интермедијери су изостављени ради прегледности.
Масне киселине се формирају посредством масно киселинских синтаза којима се полимеризују и затим редукују ацетил-КоА јединице. Ацилни ланци у масним киселинама се продужују путем циклуса реакција којима се додаје ацил група, редукује до алкохола, дехидрира до алкенске групе и затим поново редукује до алканске групе. Ензими биосинтезе масних киселина се деле у две групе: код животиња и гљива све реакције синтезе масних киселина посредује један мултифункционални протеин типа I,[58] док у биљним пластидима и бактеријама засебни ензими типа II посредују сваки корак биохемијских путева.[59][60]
Терпени и изопреноиди су велика класа липида која обухвата каротеноиде и формира највећу класу биљних природних производа.[61] Ова једињења се формирају путем састављања и модификације изопренских јединица донираних из реактивних прекурзора изопентенил пирофосфата и диметилалил пирофосфата.[62] Ови прекурзори могу да буду формирани на различите начине. Код животиња и археја, мевалонатним путем се производе ова једињења из ацетил-КоА,[63] док у биљкама и бактеријама немевалонатни пут користи пируват и глицералдехид 3-фосфат као супстрате.[62][64] Једна важна реакција у којој се користе ови активирани изопренски донори је биосинтеза стероида. Овде се изопренске јединице спајају и формира се сквален који затим поприма конформацију подесну за формирање сета прстенова, која је прекурзор ланостерола.[65] Ланостерол затим може да буде конвертован у друге стероиде, као што су холестерол и ергостерол.[65][66]
Протеини
Организми варирају у погледу њихове способности да синтетишу 20 протеиногених аминокиселина. Већина бактерија и биљки може да синтетише свих двадесет, док животиње могу да синтетишу само једанаест неесенцијалних аминокиселина, а девет есенцијалних аминокиселина се морају уносити путем хране.[8] Неким једноставним паразитима, као што је бактерија Mycoplasma pneumoniae, недостаје способност синтезе свих аминокиселина и они морају да преузимају све аминокиселине директно од њихових домаћина.[67] Све аминокиселине се синтетишу из интермедијера у биохемијском путу гликолизе, циклуса лимунске киселине, или пентозног фосфата. Као извор азота користи се глутамат и глутамин. Синтеза аминокиселина зависи од формирања подесне алфа-кето киселине, која затим бива трансаминисана до аминокиселине.[68]
Аминокиселине се користе као градивни блокови протеина. Оне се спајају у ланце путем пептидних веза. Сваки протеин има своју јединствену секвенцу аминокиселинских остатака: то је његова примарна структура. Као што се слова алфабета могу комбиновати и формирати скоро бескрајно мноштво различитих речи, аминокиселине се могу повезати у различитим секвенцама како би се формирало огромно мноштво различитих протеина. Протеини се праве од аминокиселина које су биле активиране везивањем за молекул транспортне РНК путем естарске везе. Овај аминоацил-тРНК прекурзор се формира реакцијом која је зависна од ATP и која се одвија посредством аминоацил тРНК синтетазе.[69] Молекул аминоацил-тРНк је затим супстрат за рибозом, који додаје аминокиселину на протеински ланац, користећи секвенциону информацију у информационој РНК.[70]
Нуклеотидна синтеза и спасавање
Нуклеотиди се формирају из аминокиселина, угљен-диоксида и мравље киселине у биохемијском путу у коме се троши велика количина метаболичке енергије.[71] Консеквентно, већина организама има ефикасне системе за поновну употребу већ формираних нуклеотида.[71][72]Пурини се синтетишу као нуклеозиди (базе везане за рубозу).[73]Аденин и гванин се формирају из прекурзорног нуклеозида инозин монофосфата, који се синтетише користећи атоме из аминокиселина глицина, глутамина, и аспартинске киселине, као и формата пренесеног са коензима тетрахидрофолата. Пиримидини се, међутим, синтетишу из базе оротата, која се формира из глутамина и аспартата.[74]
Енергија
Оксидацијска фосфорилација

Механизам ATP синтазе. ATP је приказан црвеном бојом, ADP и форсфат су обојени љубичасто, а ротирајућа подјединица црно.
У процесу оксидативне фосфорилације електрони уклоњени са органских једињења у метаболичким путевима, као што је нпр. Кребсов циклус, преносе се на молекул кисеоника при чему се настала енергија користи за синтезу ATP молекула. Код еукариота пренос електрона обавља низ протеинских комплекса на унутрашњој мембрани митохондрија. Тај низ протеина користи енергију насталу преносом електрона за испумпавање протона изван митохондрија и чини респираторни ланац. Протеински комплекси делују тако да преносе електрон из једног активног места у комплексу на друго, при чему у свакој реакцији електрон губи малу количину енергија, која се на тај начин врло ефикасно користи за испумпавање протона изван митохондрија. Испумпавањем протона настаје на мембрани митохондрија електрохемијски градијент,[75] због разлике у концетрацији протона. Изпумпани протони се враћају унутар митохондрија помоћу ензима ATP синтаза, који користи њихов проток низ градијент са синтезу ATP-а из АДП-а.[18] Тај проток се може користити и за друге процесе у ћелији.
Код прокариота, ови протеини се налазе на унутрашњој мембрани ћелија.[76] Ови протеини користе енергију ослобођену пролазом електрона са редукованих молекула као што је NADH на кисеоник за пумпање протона кроз мембрану.[77]
Енергија из неорганских једињења
Хемолитотрофни организми су група прокариота који енергију добијају оксидацијом неорганских једињења. Ови организми могу да користе водоник,[78] једињења које садрже редуковани сумпор (сулфид, водоник сулфид, тиосулфат),[2]гвожђе(II)-оксид[79] или амонијак,[80] као електронске доноре. Електрони се у респираторном ланцу искориштавају за добивање ATP-а, док су електрон акцептори молекули попут кисеоника или нитрита.[81] Ови процеси који се одвијају у микроорганизмима могу бити од велике важности у глобалном биогеохемијским циклусима, као што су ацетогенеза, нитрификација тла и денитрификација, и они су од критични за плодност земљишта.[82][83]
Енергија сунчеве светлости
Енергију из сунчеве светлости користе биљке, одређене групе бактерија[84] (модрозелене бактерије, пурпурне бактерије,[85]зелене сумпорне бактерије[86][87]) и протисти. Овај процес је обично спрегнут са конверзијом угљен-диоксида у органска једињења, што је део фотосинтезе. Системи за прихват енергије и фиксирање угљеника могу међутим засебно да делују код прокариота, будући да пурпурне бактерије и зелене сумпорне бактерије могу да користе сунчеву светлост као извор енергије, уз прелаз између фиксације угљеника и ферментације органских једињења.[88][89]
У многим организмима прихват соларне енергије је у принципу сличан са оксидативном фосфорилацијом, јер укључује складиштење енергије у виду градијента протонске концентрације. Ова сила протонског кретања затим покреће ATP синтезу.[18] Електрони потребни за вођење овог електронског транспортног ланца потичу од протеина за прикупљање светлости званих фотосинтетички реакциони центри или родопсини. Реакциони центери се класификују у два типа у зависности од типа присутног фотосинтетског пигмента, при чему већина фотосинтетичких бактерија поседује само један тип, док биљке и модрозелене бактерије имају два.[90]
У биљкама, алгама и модрозеленим бактеријама, фотосистем II користи светлосну енергију за уклањање електрона из воде, чиме се ослобађа кисеоник као отпадни продукат. Електрони затим теку до цитохром б6ф комплекса, који користи њихову енергију за пумпање протона кроз тилакоидну мембрану у хлоропластима.[32] Ови протони се враћају кроз мембрану и омогућавају дејство ATP синтазе. Електрони затим пролазе кроз фотосистем I и могу да буду кориштени за редуковање коензима NADP+, да буду употребљени у Калвиновом циклусу, или да буду рецикловани за даље ATP генерисање.[91]
Метаболизам азота
Азотни метаболизам подразумева процесе у којима се синтетишу азотна једињења и у којима долази до испуштања азота из организама, као и биолошки процес азотног циклуса:
Циклус урее је важан процес у коме долази до испуштања азота из организма у облику урее- Биолошка азотофиксација
- Азотна асимилација
- Нитрификација
- Денитрификација
Азотни циклус je биогеохемијски циклус путем кога се азот конвертује у вишеструке хемијске форме док циркулише између атмосфере, земљишта и морског екосистема. До конверзије азота може доћи путем биолошких и физичких процеса. Важни процеси у азотном циклусу су фиксација, амонификација, нитрификација, и денитрификација. Већински део земљине атмосфере (78%) се састоји од азота,[92] те је она велики извор азота. Међутим, атмосферски азот има ограничену доступност за биолошке примене, што доводи до недостатака употребљивог азота у многим типовима екосистема.
Азотни циклус је посебно значајан за екологију, јер азотна доступност може да утиче на брзину процеса у екосистему, укључујући примарну продукцију и декомпозицију. Људске активности као што је сагоревање фосилних горива, употреба вештачих азотних ђубрива, и испуштање азота у водене токове су драматично промениле глобални азотни циклус.[93][94]
Метаболизам лекова
Цитохром П450 оксидазе су важни ензими у метаболизму ксенобиотика.[95] Више од 50.000 дистинктних CYP протеина је познато.[96]

Глутатион S-трансферазе[97][98][99][100][101] из Anopheles cracens, 1R5A[102] Ензими ове фамилије еукариотиских и прокариотских метаболичких изозима су најбоље познати по њиховој способности катализе конјугације редуковане форме глутатиона (GSH) на ксенобиотичке супстрате у процесу детоксификације.
Метаболизам лекова је метаболичко разлагање лекова у живим организмима, обично посредством специјализованих ензиматских система. Општије гледано, ксенобиотички метаболизам (од грчке речи xenos „странац” и biotic „везан за жива бића” је сет метаболичких путева који модификују хемијске структуре ксенобиотика, који су страна једињења за нормалну биохемију организма, као што су лекови или отрови. Ови биохемијски путеви су форма биотрансформације која је присутна у свим главним групама организама, и сматра се да су древног порекла. Те реакције обично делују с циљем детоксикације отровних једињења[103] (мада у неким случајевима интермедијери ксенобиотичког метаболизма могу и сами да узрокују токсичне ефекте). Изучавање метаболизма лекова се назива фармакокинетиком. Модификација или деградација лекова и других ксенобиотичких једињења се првенствено врши путем следећих система:
Цитохром П450 оксидазни систем- Монооксигеназни систем који садржи флавин
- Метаболизам алкохола
Сви организми су константно изложени једињењима која они не могу да користе за храну и која могу да буду штетна ако се акумулирају у ћелијама, јер немају метаболичке функције.[104] Ксенобиотици као што су синтетички лекови, природни отрови и антибиотици бивају детоксификовани посредством сета ксенобиотичких-метаболизирајућих ензима. Код људи, они обухватају цитохром П450 оксидазе,[105]UDP-глукуронозилтрансферазе,[106] и глутатион S-трансферазе.[107] Овај систем ензима делује у три ступња да прво оксидује ксенобиотик (фаза I) и затим конјугује у води растворне групе на молекул (фаза II). Модификовани у води растворни ксенобиотик затим може да буде испумпан из ћелије, и у вишећелијским организмима може да буде даље метаболизован пре него што се излучи (фаза III). У екологији, те реакције су посебно важне при микробној биодеградацији загађивача и биоремедијацији контаминираног земљишта и нафтних изливања.[108] Многе од тих микробних реакција се одвијају и у вишећелијским организмима, али због невероватне разноликости постојећих врста микроба, ови организми су у стању да метаболизују далеко шири распон ксенобиотика од вишећелијских организама, и могу да деградирају чак и перзистентне органске загађиваче као што су органохлоридна једињења.[109]
Сродни проблем за аеробне организме је оксидативни стрес.[110] Овде, процеси који обухватају оксидативна фосфорилацију и формирање дисулфидних веза током протеинског савијања производе реактивне врсте кисеоника, као што је водоник пероксид.[111] Ови штетни оксиданси се уклањају помоћу антиоксидансних метаболита, као што је глутатион, и ензима, као што су каталазе и пероксидазе.[112][113]
Метаболизам фармацеутских лекова је важан аспект фармакологије и медицине. На пример, брзина метаболизма одређује трајање и интензитет фармаколошког дејства лека. Метаболизам лека исто тако може да утиче на отпорност на вишеструке лекове код инфективних болести, и на хемотерапију за третирање канцера. Дејство неких лекова као што супстрати или инхибитори ензима који учествују у ксенобиотичком метаболизму су чест разлог хазардних интеракција лекова. Ови путеви су исто тако важни у науци о животној средини, при чему ксенобиотички метаболизам микроорганизама одређује да ли ће загађивач бити разложен током процеса биоремедијације, или ће бити перзистентан у околини. Ензими ксенобиотичког метаболизма, а посебно глутатион S-трансферазе су такође важни у пољопривреди, пошто они могу да произведу отпорност на пестициде и хербициде.
Пермеабилносне баријере и детоксификација
Прецизна композиција једињења којима је изложен организам је у великој мери непредвидљива и може се с временом знатно разликовати. То је главна карактеристика ксенобиотског токсичног стреса.[114] Главни изазов са којим се суочавају ксенобиотски системи детоксификације је да морају да буду у стању да уклоне скоро неограничен број ксенобиотских једињења из комплексне мешавине хемикалија која учествује у нормалном метаболизму. Решење које је еволуирало за адресирање овог проблема је елегантна комбинација физичких баријера и ниско специфичних ензиматских система.
Сви организми користе ћелијске мембране као хидрофобне пермеабилносне баријере за контролу приступа њиховој унутрашњој средини. Поларна једињења не могу да прођу путем дифузије кроз те ћелијске мембране, и унос корисних молекула је посредован транспортним протеинима који специфично одабирају супстрате из екстрацелуларне смеше. Овај селективни унос српечава улаз већини хидрофилних молекула у ћелије, пошто њих не препознаје било који специфични транспортер.[115] У контрасту с тим, дифузија хидрофобних једињења кроз те баријере се не може контролисати, и организми стога не могу да искључе ксенобиотике растворне у липидима користећи мембранске баријере.
Међутим, постојање пермеабилносних баријера значи да су организми успешно еволуирали детоксификационе системе који експлоатишу хидрофобност заједничку за мембранско-пермеабилне ксенобиотике. Ови системи стога решавају проблем специфичности путем поседовања тако широких супстратних специфичности да они метаболизују скоро сва неполарна једињења.[114] Корисни метаболити су искључени пошто су они поларни, и генерално садрже једну или више наелектрисаних група.
Детоксификација реактивних нуспродуката нормалног метаболизма се не може остварити горе описаним системима, пошто су ти молекулски ентитети изведени из нормалних ћелијских конституената и обично деле њихове поларне карактеристике. Међутим, пошто та су ова једињења малобројна, специфични ензими могу да их препознају и уклоне. Примери таквих специфичних детоксификационих система су глиоксалазни систем, који уклања реактивни алдехид метилглиоксал,[116] и разни антиоксидантски системи који елиминишу реактивне врсте кисеоника.[117]
Фазе детоксификације

Фазе I и II метаболизма липофилних ксенобиотика.
Метаболизам ксенобиотика се обично дели у три фазе: модификација, конјугација, и екскреција. Ове реакције делују у међусобном складу тако да се ксенобиотици детоксификују и бивају уклоњени из ћелија.
Фаза I – модификација
У фази I, дејством различитих ензима се уводе реактивне и поларне групе у ензимске супстрате. Једна од најчешћих модификација је хидроксилација коју катализује оксидазни систем мешовите функције који је завистан од цитохрома П-450. Ови ензимски комплекси делују тако што инкорпорирају атом кисеоника у неактивиране угљоводонике, што може да доведе било до увођења хидроксилних група или N-, O- и S-деалкилације супстрата.[118] Реакциони механизам П-450 оксидаза се одвија путем редукције кисеоника везаног за цитохром и генерације веома реактивних оксиферилних ентитета, према следећој схеми:[119]
- O2 + NADPH + H+ + RH → NADP+ + H2O + ROH
Реакције фазе I (које се такође називају несинтетским реакцијама) могу се обухватају оксидацију, редукцију, хидролизу, циклизацију, дециклизацију, и адицију кисеоника или уклањање водоника, посредством оксидаза мешовите функције, обично у јетри. Ове оксидативне реакције типично обухватају цитохром П450 монооксигеназе (које се обично скраћено обележавају са CYP), NADPH и кисеоник. Класе фармацеутских лекова које овим методом бивају метаболизоване обухватају на пример фенотиазине, парацетамол, и стероиде. Ако су метаболити реакција фазе I довољно поларни, они лако могу да буди излучени. Међутим, многи продукти фазе I не бивају брзо елиминисани и подлежу накнадној реакцији у којој се ендогени супстрат комбинује са новоинкорпорираном групом чиме се формира високо поларни конјугат.
Чести вид оксидације у фази I је конверзија C-H везе у C-OH. Овом реакцијом се понекад конвертује фармаколошки неактивно једињење (пролек) до фармаколошки активног једињења. По истом принципу, у фази I може доћи до преображаја нетоксичног молекула у отровни (токсификација). Једноставна хидролиза у стомаку је нормално нешкодљива реакција, међутим постоје изузеци. На пример, метаболизмом фазе I се конвертује ацетонитрил до HOCH2CN, који се брзо дисоцира у формалдехид и водоник цијанид.[120]
Метаболизам фазе I неког молекула који је кандидат за лек се може лабораторијски симулисати користећи неензимске катализаторе.[121] Овај пример биомиметичке реакције има тенденцију стварања продуката који обично садрже метаболите фазе I. На пример, главни метаболит фармацеутског тримебутина, десметилтримебутин (нор-тримебутин), се може ефикасно произвести путем in vitro оксидације комерцијално доступног лека. Хидроксилација N-метил групе доводи до одвајања молекула формалдехида, док се оксидација O-метил групе одвија у мањој мери.
- Оксидација
- Цитохром П450 монооксигеназни систем
- Монооксигеназни систем који садржи флавин
Алкохолна дехидрогеназа и алдехидна дехидрогеназа- Моноаминска оксидаза
- Кооксидација пероксидазама
- Редукција
- NADPH-цитохром П450 редуктаза
Цитохром П450 редуктаза, која је такође позната као NADPH:ферихемопротеинска оксидоредуктаза, NADPH:хемопротеинска оксидоредуктаза, NADPH:П450 оксидоредуктазае, П450 редуктаза, POR, CPR, CYPOR, је ензим везан за мембрану који је неопходан при трансферу електрона до цитохрома П450 у микрозому еукариотске ћелије од ензима који садрже FAD и FMN, NADPH:цитохром П450 редуктазу. Општа схема протока електрона у POR/П450 систему је: NADPH → FAD → FMN → P450 → O2
- Редуковани (феро) цитохром П450
Током реакција редукције, хемикалија може да уђе у бескорисно кружење, при чему она стиче електрон слободног радикала, затим га одмах предаје кисеонику (да формира супероксидни анјон).
- Хидролиза
Естеразе и амидазе- Епоксидна хидролаза
Фаза II – конјугација
У накнадним реакцијама фазе II, ови активирани ксенобиотички метаболити бивају конјуговани са наелектрисаним молекулким ентитетима као што су глутатион (GSH), сулфат, глицин, или глукуронска киселина. Места на лековима где долази до реакција конјугације су карбоксил (-COOH), хидроксил (-OH), амино (NH2), и сулфхидрил (-SH) групе. Продукти реакција конјугације имају повећану молекулску тежину и углавном су мање активни од њихових супстрата, што је у контрасту са реакцијама фазе I, које обично производе активне метаболите. Адиција великих анјонских група (као што је GSH) детоксификује реактивне електрофиле и тиме се формирају поларнији метаболити који не могу да пролазе кроз мембране дифузијом, и је често неопходно да буду активно транспортовани.
Ове реакције су катализоване великом групом трансфераза са широком специфичношћу, које заједно могу да метаболизују скоро сва хидрофобна једињења која садрже нуклеофилне или електрофилне групе.[114] Једна од најважнијих класа ове групе су глутатион S-трансферазе (GST).
| Механизам | Ензими | Кофактор | Локација | Извори |
|---|---|---|---|---|
| метилација | метилтрансфераза | S-аденозил-L-метионин | јетра, бубрези, плућа, ЦНС | [122] |
| сулфација | сулфотрансферазе | 3'-фосфоаденозин-5'-фосфосулфат | јетра, бубрези, црева | [122] |
| Ацетилација |
| Ацетил коензим А | јетар, плућа, слезина, слузница желуца, црвена крвна зрнца, лимфоцити | [122] |
| Глукуронидација | UDP-глукуронозилтрансферазе | UDP-глукуронска киселина | јетра, бурези, црева, плућа, кожа, простата, мозак | [122] |
| глутатионска конјугација | глутатион S-трансферазе | глутатион | јетра, бубрези | [122] |
| глицинска конјугација | Двостепни процес:
| глицин | јетра, бубрези | [123] |
Фаза III – даље модификације и екскреција
Након реакција фазе II, ксенобиотички конјугати могу даље да буду метаболизовани. Често коришћени пример је трансформација глутатионских конјугата до ацетилцистеинских (меркаптуринско киселинских) конјугата.[124] Овде, γ-глутаматни и глицински остаци у глутатионском молекулу бивају уклоњени посредством гама глутамил трансферазе и дипептидаза. У финалном кораку, цистински остатак у коњугату је ацетилисан.
Конјугати и њихови метаболити могу да буду излучени из ћелије у фази III њиховог метаболизма, при чему анјонске групе делују као ознаке афинитета за разне мембранске транспортере фамилије протеина за резистенцију на више лијекова (MRP).[125] Ови протеини су чланови фамилије ATP-везујућих касетних транспортера и могу да катализују транспорт који је завистан од ATP молекула за огромно мноштво хидрофобних анјона,[126] и тиме уклањају продукте фазе II до екстрацелуларног медијума, где они могу даље да буду метаболизовани или бивају излучени.[127]
Ендогени токсини
Детоксификација ендогених реактивних метаболита, као што су пероксиди и реактивни алдехиди, често не може да буде остварена горе описаним системом. Ово је последица тога да су ти ентитети изведени из нормалних ћелијских конституената и обично имају истоветне поларне карактеристике. Међутим, пошто постоји мали број ових једињења, ензиматски системи могу да користе специфично молекуларно препознавање, и да их на тај начин уклоне. Сличност ових молекула са корисним метаболитима стога значи да су обично неопходни различити детоксификациони ензими за метаболизам сваке групе ендогених токсина. Примери ових специфичних детоксификационих система су глиоксалазни систем, којим се уклања реактивни алдехидни метилглиоксал,[116] и разни антиоксидансни системи који елиминишу реактивне врсте кисеоника.[117]
Локације
Квантитативно, глатки ендоплазматични ретикулум ћелија јетре је главни орган метаболизма лекова, мада свако биолошко ткиво има извесну способност метаболизовања лекова. Фактори одговорни за јетрени допринос метаболизму лекова су да је то велики орган, да је то први орган кроз који пролазе хемикалије апсорбоване у гастроинтестиналном тракту, и да у њему постоји веома висока концентрација већине ензима који метаболизују лекове, у поређењу са осталим органима. Ако је лек који је унет у ГИ тракт ушашао у хепатичку циркулацију кроз порталну вену, и постао подробно метаболизован, каже се да испољава ефекат првог пролаза.
Друга места метаболизма лекова обухватају епителско ткиво гастроинтестиналног тракта, плућа, бубреге, и кожу. Та места су обично одговорна за локализоване реакције токсичности.
Фактори који утичу на метаболизам лекова
Трајање и интензитет фармаколошког дејства већине липофилних лекова је одређен брзином којом се они метаболизују до неактивних продуката. Систем цитохром П450 монооксигеназе је најважнији пут у том погледу. Генерално, све што повећава врзину метаболизма (e.g., ензимска индукција) фармаколошки активног метаболита ће смањити трајање и интензитет дејства лека. Супротно исто тако важи (e.g., ензимска инхибиција). Међутим, у случајевима где је ензим одговоран за метаболизовање пролека у лек, ензимска индукција може да убрза ту конверзију и да повећа ниво лека, потенцијално узрокујући токсичност.
Разни физиолошки и патолошки фактори исто тако могу да утичу на метаболизам лекова. Физиолошки фактори који могу да утичу на метаболизам лекова су старост, индивидуалне варијације (e.g., фармакогенетика), ентерохепатичка циркулација, исхрана, интестинална флора, или полне разлике. Генерално, лекови се спорије метаболизују код феталних, неонаталних и старих људи и животиња, него код одраслих.
Генетичке варијације (полиморфизам) доприносе делу варијабилности која има утицаја на лекове. Код N-ацетилтрансфераза (које учествују у ракцијама фазе II), индивидуалне варијације креирају групу особа које спорије ацетилирају (спори ацетилатори) и оне који брзо ацетилирају, при чему је популација подељена, нпр. 50:50 у Канади. Ова варијација може да има драматичне последице, пошто су спори ацетилатори склонији токсичности зависној од дозе.
Ензими система цитохромне П450 монооксигеназе исто тако могу да варирају међу особама, при чему се разлике јављају код 1 – 30% људи, у зависности од њиховог етничког порекла.
Доза, фреквенција, рута администрације, ткивна дистрибуција и протеинско везивање лека утичу на његов метаболизам. Патолошки фактори исто тако могу да утичу на метаболизам лекова, чиме су обухваћене болести јетре, бубрега, и срца.
Методе in silico моделовања и симулације омогућавају предвиђање метаболизма лекова код виртуалних пацијената пре спровођења клиничких студија на људским субјектима.[128] Ово се може користити за идентификацију особа са највећим ризиком од непожељних реакција.
Термодинамика живих организама
Живи организми морају да подлежу законима термодинамике, који описују трансфер топлоте и рада. Други принцип термодинамике налаже да у сваком затвореном систему, количина ентропије (нереда) не може да буде смањена. Мада изузетна комплексност живих организама наизглед стоји у контрадикцији са овим законом, живот је могућ јер су сви организми отворени системи који размењују материју и енергију са својим окружењем. Стога живући системи нису у еквилибријуму, већ су дисипативни системи који одржавају своје стање високе комплексности узрокујући велика повећања ентропије у својим окружењима.[129] Метаболизам ћелија остварује то спрезањем спонтаних процеса катаболизма са неспонтаним процесима анаболизма. У термодинамичком смислу, метаболизам одржава ред путем креирања нереда.[130]
Поље биолошке термодинамике има фокус на принципима хемијске термодинамике у биологији и биохемији. Покривени принципи обухватају први принцип термодинамике, други принцип термодинамике, Гибсову слободну енергију, статистичку термодинамику, реакциону кинетику, и хипитезе о пореклу живота. Тренутно се биолошка термодинамика бави проучавањем унутрашње биохемијске динамике, као што је: ATP хидролиза, протеинска стабилност, ДНК везивање, мембранска дифузија, ензимска кинетика,[131] и другим есенцијалним енергетски контролисаним путевима. У погледу термодинамике, количина енергије која има способност вршења рада током хемијске реакције се квантитативно мери променом Гибсове слободне енергије. Физички биолог Алфред Лотка је покушао да уједини промену Гибсове енергије са еволуционом теоријом.
Енергија трансформације у биолошким системима
Сунце је примарни извор енергије за живе организме. Неким живим организмима попут биљки је неопходна директна сунчева светлост, док други организми попут људи могу индиректно да стекну сунчеву енергију.[132] Независно од типа живе врсте, сви живи организми морају да заробе, преносе, складиште и користе енергију да би опстали.
Однос између енергије приспеле сунчеве светлости и њене таласне дужине λ или фреквенције ν је дат изразом
- E=hcλ=hν,displaystyle E=frac hclambda =hnu ,
где је h Планкова константа (6,63x10−34Js), а c је брзина светлости (2,998x108 m/s). Биљке користе светлосну енергију за спровођење процеса фотосинтезе, чиме ефективно конвертују соларну у хемијску енергију. Да би поново пренеле енергију животиње се хране биљкама, и користе енергију свареног биљног материјала за креирање биолошких макромолекула.
Регулација и контрола
Како се окружења већине организама стално мењају, реакције метаболизма морају да буду деликатно регулисане да би се одржао константан сет услова унутар ћелија, стање које се назива хомеостаза.[133][134] Метаболичка регулација исто тако омогућава организмима да одговоре на сигнале и да формирају активне интеракције са својим окружењем.[135] Два блиско повезана концепта су важна за разумевање начина на који су метаболички путеви контролисани. Прво, регулација ензима у биохемијском путу је начин на који се његова активност повећава и умањује у респонсу на сигнале. Друго, контрола коју врши тај ензим је ефекат који те промене активности имају на свеукупну брзину пута (флукс кроз пут).[136] На пример, ензим може да испољи велике промене у активности (i.e. он је високо регулисан), али ако те промене имају мало утицаја на флукс метаболичког пута, онда тај ензим не учествује у контроли тог пута.[137]

Ефекат инсулина на унос глукозе и метаболизам. Инсулин се везује за свој рецептор (1), који затим започиње многе каскаде протеинске активације (2). Тиме су обухваћени: транслокација Глут-4 транспортера до ћелијске мембране и прилив глукозе (3), синтеза гликогена (4), гликолиза (5) и синтеза масних киселина (6).
Постоје вишеструки нивои метаболичке регулације. У унутрашњој регулацији, метаболички пут сам регулише одговоре на промене нивоа супстрата или продуката; на пример, смањење количине производа може повећати флукс кроз пут ради компензовања промене.[136] Овај тип регулације често обухвата алостерну регулацију активности вишеструких ензима на путу.[138] Спољашња контрола обухвата ћелију у вишећелијском организму која мења свој метаболизам као одговор на сигнале од других ћелија. Ти сигнали су обично у форми растворних гласника, као што су хормони и фактори раста, a њих детектују специфични рецептори на површини ћелије.[139] Ти сигнали се затим трансмитују унутар ћелије путем система секундарних гласника, што често обухвата фосфорилацију протеина.[140]
Врло добро изучен пример екстерне контроле је регулација метаболизма глукозе помоћу хормона инсулина.[141] Инсулин се производи у респонсу на повећање нивоа крвне глукозе. Везивање хормона за инсулинске рецепторе на ћелијама затим активира каскаду протеинских киназа, што узрокује да ћелија преузме глукозу и конвертује је у складишне молекуле, као што су масне киселине и гликоген.[142] Метаболизам гликогена је контролисан активношћу фосфорилазе, ензима који разлаже гликоген, и гликогенске синтазе, ензима који посредује његово формирање. Ови ензими су регулисани у реципрочном маниру, при чему фосфорилација инхибира гликогенску синтазу, и активира фосфорилазу. Инсулин узрокује синтезу гликогена активирањем протеинске фосфатазе и производећи смањење фосфорилације тих ензима.[143]
Регулаторни ензими су обично први у секвенци мултиензимског система: производ реакције катализован првим ензимом је супстрат другог ензима, тако да ћелија може да контролише количину добијеног производа регулацијом активности првог ензима метаболичког пута. Постоји више стратегија активације и деактивације регулаторних ензима. Регулаторни ензими захтевају додатни процес активације и морају проћи кроз извесне модификације у својој просторној структури, како би постали функционални, на пример, катализујући ензими (регулаторни ензими). Регулација активације катализујућих ензима је неопходна да би се регулисала свеукупна брзина реакције, и да би се добила количина производа која је неопходна у датом тренутку, те стога регулаторни ензими имају биолошку важност. Постоје два типа активације регулаторних ензима: алостерна и ковалентно модулисана; мада, ензим може да комбинује оба типа регулације.
Алостерни ензими
Овај тип ензима садржи два места везивања: супстратно и ефекторско. Ефектори су мали молекули који модулишу ензимску активност; они функционишу путем реверзибилног, нековалентног везивања регулаторног метаболита у алостерном месту (које није активно место). Кад су везани, ови метаболити не учествују директно у катализи, али су упркос тога они есенцијални: они доводе до конформационих промена у датом делу ензима. Ове промене утичу на свеукупну конформацију активног места, узрокујући промене активности реакције.[144]
- Својства
Алостерни ензими генерално имају већу масу од других ензима. Осим ензима са једном подјединицом, постоје и они са више подјединица, који могу да имају активно место и регулаторно место на различитим подјединицама. Они испољавају специјалну кинетику: кооперацију. У овом случају, конфигурационе промене у сваком протеинском ланцу производе промене у другим ланцима. Ове промене се јављају на терцијарними и кватернарним нивоима организације. На основу модулације, они се могу класификовати у две различите групе:
Хомотропни алостерни ензими: супстрат и ефектор учествују у модулацији ензима, што утиче на ензимску каталитичку активност.
Хетеротропни алостерни ензими: само ефектор учествује у модулацији.
- Повратна инхибиција
У неким мултиензимским системима, ензим бива инхибиран крајњим продуктом, кад год је његова концентрација превазиђе потребе ћелије. Стога се брзина реакције може контролисати количином продукта који је неопходан ћелији (што су потребе мање, то спорије реакција тече).
Повратна инхибиције је једна од најважнијих функција протеина. Путем повреатне инхибиције, ћелија може да зна да ли је количина продукта довољна за њено издржавање, или постоји недостатак прудукта (или је концентрација продукта превелика). Ћелија има способност реаговања на ту врсту ситуације на механички начин и да тако решава проблем количине продукта. Један пример повратне инхибиције у људским ћелијама је протеин аконитаза (ензим који катализује изомеризацију цитрата у изоцитрат). Кад је ћелији потребно гвожђе, овај ензим губи молекул гвожђа и његова форма се мења. Кад дође до тога, аконитаза се конвертује у IRPF1, транслациони репресор или иРНК стабилизатор, који сузбија формирање протеина који везују гвожђе и поспешује формирање протеина који могу да узму гвожђе из ћелијских резерви.[144][145]
Ковалентно модулисани ензими
При овом виду контроле активне и неактивне форме ензима се мењају услед ковалентне промене њихових структура, што је катализовано другим ензимима. Овај тип регулације се састоји од адиције или елиминације појединих молекула који могу да буду везани за ензим. Најважније групе које се користе као модификатори су фосфати, метил, уридин, аденин и аденозин дифосфат рибозил. Ове групе бивају додате или елиминисане са протеинских структура посредством других ензима. Најзначајнија ковалентна модификација је фосфорилација. Серин, треонин и тирозин су обично аминокиселине које учествују у ковалентним модификацијама и које се користе за контролу ензимских каталитичких активности. Киназе и фосфатазе су најпознатије класе ензима које посредују ове модификације, којима се узрокују промене конформационих стања и тиме афинитет везивања супстрата.
Еволуција

Еволуционо стабло приказује заједничко порекло организама из сва три домена живота. Бактерије су обојене плаво, еукариоте црвено, а археје зелено. Релативне позиције појединих раздела су приказане на стаблу.
Централни путеви метаболизма, који су описани горе, као што су гликолиза и циклус лимунске киселине, присутни су у сва три домена живих организама и били су присутни код задњег универзалног заједничког претка.[4][146] Та универзална предачка ћелија је била прокариотска и вероватно је била метаногена. Она је имала екстензивни аминокиселински, нуклеотидни, угљено хидратни и липидни метаболизам.[147][148] Задржавање ових древних путева током касније еволуције је вероватно последица тога да су ове реакције оптимално решење специфичног метаболичког проблема, при чему путеви као што су гликолиза и циклус лимунске киселине производе своје крајње производе веома ефикасно и у минималном броју корака.[5][6] Могуће је да су први путеви ензимски посредованог метаболизма били делови пуринског нуклеотидног метаболизма, док су претходни метаболички путеви били део древног РНК света.[149]
Многи модели су предложени за описивање механизама помоћу којих нови метаболички путеви еволуирају. Тиме је овухваћена секвенцијална адиција нових ензима на кратке предачке путеве, дупликација и затим дивергенција целокупних путева, као и регрутовање постојећих ензима и њихово састављање у нове реакционе путеве.[150] Релативна важност тих механизама није разјашњена, али су геномске студије показале да је за ензиме у путу вероватније да имају заједничко порекло, из чега произилази да су многи путеви еволуирали у корак-по-корак маниру, при чему су нове функције креиране из постојећих корака у путу.[151] Један алтернативни модел потиче из студије која прати еволуцију структура протеина у метаболичким мрежама. Тај модел сугерише да ензими у знатној мери бивају регрутовани или позајмљени да изводе сличне функције у различитим метаболичким путевима. Ово је евидентно у MANET бази података.[152] Ови процеси регрутовања доводе до еволуционог ензиматског мозаика.[153] Трећа могућност је да неки делови метаболизма могу да постоје као „модули” који се могу поново користити у различитим путевима и вршити сличне функције на различитим молекулима.[154]
Осим еволуције нових метаболичких путева, еволуција може изазвати и губитак метаболичких функција. На пример, у неким паразитима метаболички процеси који нису есенцијални за опстанак су изгубљени, и постојеће аминокиселине, нуклеотиди и угљени хидрати се уместо тога узимају од домаћина.[155] Сличне редуковане метаболичке способности су уочене код ендосимбиотских организама.[156]
Истраживања

Метаболичка мрежа циклуса лимунске киселине врсте Arabidopsis thaliana. Ензими и метаболити су приказани црвеним квадратима а интеракције међу њима црним линијама.
Класично, метаболизам се проучаван користећи редукционистички приступ који је усредсрећен на појединачни метаболички пут. Посебно је вредна употреба радиоактивних обележивача на нивоима целог организма, ткива и ћелија, који дефинишу путеве од прекурзора до финалних продуката тако што идентификују радиоактивно обележне интермедијере и продукте.[157] Ензими који катализују ове хемијске реакције могу затим да буду пречишћени и њихова кинетика и респонси на инхибиторе истражени. Паралелни приступ је да се идентификују мали молекули у ћелијама или ткивима. Комплетан сет тих молекула се назива метаболом. Свеукупно, ове студије дају добар увид у структуру и функцију једноставних метаболичких путева, али су неадекватне кад се примене на комплексније системе као што је метаболизам комплетне ћелије.[158]
Идеја комплексности метаболичке мреже у ћелијама које садрже хиљаде различитих ензима је илустрована сликом на којој су приказане интеракције између само 43 протеина и 40 метаболита. Геномска секвенца садржи око 45.000 гена, знатан део којих бива изражен у специфичним ћелијским типовима.[159] У данашње време је могуће да се користе геномски подаци за реконструисање комплетних мрежа биохемијских реакција и да се формирају холистички математички модели, који боље објашњавају и предвиђају понашање метаболичких мрежа.[160] Ови модели су посебно корисни кад се користе при интеграцији биохемијских путева и метаболичких података прикупљених применом класичних метода са подацима о изражавањима гена из протеомских студија и из ДНК микрочипова.[161] Користећи те технике, произведен је модел људског метаболизма, који налази примену у усмеравању будућих активности на откривању лекова, као и у биохемијским истраживањима.[162] Ови математички модели се користе у анализи мрежа, за класификовање људских болести у групе са заједничким протеинима или метаболитима.[163][164]
Бактеријске метаболичке мреже су упечатљив пример организације „лептир машне”[165][166][167], архитектуре која има способност уноса широког опсега нутријената и која производи мноштво разноврсних производа и сложених макромолекула користећи релативно мали број интермедијерних заједничких компоненти.
Главни вид технолошке примене ових информација је метаболички инжењеринг. Организми као што су квасац, биљке или бактерије се генетички модификују да би се учинили кориснијим у биотехнолошким применама и да би се омогућила продукција појединих лекова, као што су антибиотици, или индустријске хемикалије, као што су 1,3-пропандиол и шикиминска киселина.[168][169][170] Циљ генетичке модификације обично је да се редукују количина енергије која се користи при производњи производа, да се повећа принос и да се редукује настанак отпада.[171]
Историја
Историја истраживања метаболизма је пар миленијума дуга. Термин метаболизам је изведен из грчке речи Μεταβολισμός – Metabolismos са значењем „промена”, или „пребачај”.[172]

Аристотелов метаболизам као модел отвореног протока

Санторио у свом равнотежном балансу, на слици која је преузета из књиге Ars de statica medicina, први пут објављене 1614.
Аристотелов рад Делови животиња поставио је довољно детаља о његовом гледишту на метаболизам да се може формирати модел отвореног протока. Он је сматрао да у сваком ступњу процеса, материјали из хране бивају трансформисани, уз ослобађање топлоте као класичног елемента ватре, и уз излучивање резидуаланих материјала као што су урин, жуч, или фекалије.[173]
Један од раних концепата метаболизма сеже из 13. века од Ибн ал-Нафиса (1213-1288), који је установио да су тело и његови делови у сталном стању трошења енергије и храњења, па се стога у телу одвијају сталне промене.[174] Историја научног изучавања метаболизма обухвата неколико векова и прешла је са испитивања целих животиња у раним студијама, на испитивање индивидуалних метаболичких реакција у модерној биохемији. Први контролисани експеримент објавио је Санторио Санторио 1614. године у својој књизи Ars de statica medecina,[175] где је описао промене своје тежине пре и после јела, спавања, рада, полног односа, поста, пијења, напрезања. Открио је да већина поједене хране је изгубљена у процесу који је он назвао „инсензибилна перспирација“.
У тим раним студијама, механизам метаболичких процеса није био одређен, и сматрало се да витална сила анимира жива ткива.[176] У 19. веку је истраживањем алкохолног врења, претварања шећера у алкохол помоћу квасаца, Луј Пастер је закључио да врење катализује материја унутар гљивица, коју је назвао „фермент“.[177] Даље је закључио да је алкохолно врење процес повезан за животом ћелија гљивица, а не са смрћу ћелија. То откриће, заједно с радом Фридриха Велера из 1828. године о хемијској синтези урее,[178] доказало је да се органска једињења и хемијске реакције из ћелија не разликују у својим начелима од остале материје.
Изучавање начина на који људи трансформишу супстанце које су прогутали или на неки други начин унели у тело је започело у средином деветнаестог века, са открићем да органски молекули као што је benzaldehиd могу да буду оксидовани и конјуговани до аминокиселина у људском телу.[179] Током остатка деветнаестог века, неколико других основих реакција детоксификације је откривено, као што су метилација, ацетилација, и сулфонација.
Откриће ензима на почетку 20. века (Едуард Бухнер) одвојило је истраживање хемијских реакција метаболизма од биолошког истраживања ћелије и означило настанак биохемије.[180] У бројним открићима на подручју биохемије у првој пловини 20. века, посебно се истиче оно Ханса Кребса, који је направио огромне доприносе изучавању метаболизма.[181] Он је открио циклус урее[182] и касније, радећи са Хансом Корнбергом, циклус лимунске киселине и циклус глиоксилата.[183][184][54] Модерна биохемијска истраживања су значајно напредовала употребом нових техника хроматографије, дифракције x-зрака, НМР спектроскопије, радиоизотопног означавања, електронске микроскопије и молекуларно динамичких симулација. Ове технике су омогућиле откриће и детаљну анализу многих молекула и метаболичких путева у ћелијама.
У раном двадесетом веку, рад је прешао на испитивање ензима и путева који су одговорни за производњу ових метаболита. Ово поље је постало дефинисано као посебна област студирања са објављивањем књиге Ричарда Вилијама Детоксикациони механизми 1947. године.[185] Ова модерна биохемијска истраживања резултирала су у идентификацији глутатион S-трансфераза 1961. године,[186] чему су следила открића цитохрома П450 у 1962. године,[187] и поимање њихове централне улоге у ксенобиотичком метаболизму 1963. године.[188][189]
Види још
- Бартов синдром
Референце
^ Voet D, Voet J (1995). Biochemistry (2 изд.). Wiley.
↑ 2,02,1 Friedrich, C. (1998). „Physiology and genetics of sulfur-oxidizing bacteria”. Adv Microb Physiol. Advances in Microbial Physiology. 39: 235—89. ISBN 9780120277391. PMID 9328649. doi:10.1016/S0065-2911(08)60018-1.
^ Pace, N. R. (2001). „The universal nature of biochemistry”. Proc. Natl. Acad. Sci. U.S.A. 98 (3): 805—8. Bibcode:2001PNAS...98..805P. PMC 33372 . PMID 11158550. doi:10.1073/pnas.98.3.805.
. PMID 11158550. doi:10.1073/pnas.98.3.805.
↑ 4,04,1 Smith E, Morowitz H (2004). „Universality in intermediary metabolism”. Proc Natl Acad Sci USA. 101 (36): 13168—73. Bibcode:2004PNAS..10113168S. PMC 516543 . PMID 15340153. doi:10.1073/pnas.0404922101.
. PMID 15340153. doi:10.1073/pnas.0404922101.
↑ 5,05,1 Ebenhöh O, Heinrich R (2001). „Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems”. Bull Math Biol. 63 (1): 21—55. PMID 11146883. doi:10.1006/bulm.2000.0197.
↑ 6,06,1 Meléndez-Hevia E, Waddell T, Cascante M (1996). „The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution”. J Mol Evol. 43 (3): 293—303. PMID 8703096. doi:10.1007/BF02338838.
^ Michie K, Löwe J (2006). „Dynamic filaments of the bacterial cytoskeleton”. Annu Rev Biochem. 75: 467—92. PMID 16756499. doi:10.1146/annurev.biochem.75.103004.142452.
↑ 8,08,18,28,38,4 Nelson & Cox 2005, стр. 841
^ Kelleher J, Bryan 3rd B, Mallet R, Holleran A, Murphy A, Fiskum G (1987). „Analysis of tricarboxylic acid-cycle metabolism of hepatoma cells by comparison of 14CO2 ratios”. Biochem J. 246 (3): 633—639. PMC 346906 . PMID 6752947.
. PMID 6752947.
^ Hothersall J, Ahmed A (2013). „Metabolic fate of the increased yeast amino acid uptake subsequent to catabolite derepression”. J Amino Acids. 2013: e461901. PMC 3575661 . PMID 23431419. doi:10.1155/2013/461901.
. PMID 23431419. doi:10.1155/2013/461901.
^ Fahy E, Subramaniam S, Brown H, Glass C, Merrill A, Murphy R, Raetz C, Russell D, Seyama Y, Shaw W, Shimizu T, Spener F, van Meer G, VanNieuwenhze M, White S, Witztum J, Dennis E (2005). „A comprehensive classification system for lipids”. J Lipid Res. 46 (5): 839—61. PMID 15722563. doi:10.1194/jlr.E400004-JLR200.
^ „Nomenclature of Lipids”. IUPAC-IUB Commission on Biochemical Nomenclature (CBN). Приступљено 8. 3. 2007.
^ Hegardt, F. (1999). „Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis”. Biochem J. 338 (Pt 3): 569—82. PMC 1220089 . PMID 10051425. doi:10.1042/0264-6021:3380569.
. PMID 10051425. doi:10.1042/0264-6021:3380569.
^ Raman R, Raguram S, Venkataraman G, Paulson J, Sasisekharan R (2005). „Glycomics: an integrated systems approach to structure-function relationships of glycans”. Nat Methods. 2 (11): 817—24. PMID 16278650. doi:10.1038/nmeth807.
^ Sierra S, Kupfer B, Kaiser R (2005). „Basics of the virology of HIV-1 and its replication”. J Clin Virol. 34 (4): 233—44. PMID 16198625. doi:10.1016/j.jcv.2005.09.004.
↑ 16,016,1 Wimmer M, Rose I (1978). „Mechanisms of enzyme-catalyzed group transfer reactions”. Annu Rev Biochem. 47: 1031—78. PMID 354490. doi:10.1146/annurev.bi.47.070178.005123.
^ Mitchell, P. (1979). „The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems”. Eur J Biochem. 95 (1): 1—20. PMID 378655. doi:10.1111/j.1432-1033.1979.tb12934.x.
↑ 18,018,118,218,3 Dimroth P, von Ballmoos C, Meier T (2006). „Catalytic and mechanical cycles in F-ATP synthases: Fourth in the Cycles Review Series”. EMBO Rep. 7 (3): 276—82. PMC 1456893 . PMID 16607397. doi:10.1038/sj.embor.7400646.
. PMID 16607397. doi:10.1038/sj.embor.7400646.
^ Coulston, Kerner & Hattner 2006
^ Pollak N, Dölle C, Ziegler M (2007). „The power to reduce: pyridine nucleotides – small molecules with a multitude of functions”. Biochem J. 402 (2): 205—18. PMC 1798440 . PMID 17295611. doi:10.1042/BJ20061638.
. PMID 17295611. doi:10.1042/BJ20061638.
↑ 21,021,1 Heymsfield S, Waki M, Kehayias J, Lichtman S, Dilmanian F, Kamen Y, Wang J, Pierson R (1991). „Chemical and elemental analysis of humans in vivo using improved body composition models”. Am J Physiol. 261 (2 Pt 1): E190—8. PMID 1872381.
^ Sychrová, H. (2004). „Yeast as a model organism to study transport and homeostasis of alkali metal cations” (PDF). Physiol Res. 53 Suppl 1: S91—8. PMID 15119939.
^ Levitan, I. (1988). „Modulation of ion channels in neurons and other cells”. Annu Rev Neurosci. 11: 119—36. PMID 2452594. doi:10.1146/annurev.ne.11.030188.001003.
^ Dulhunty, A. (2006). „Excitation-contraction coupling from the 1950s into the new millennium”. Clin Exp Pharmacol Physiol. 33 (9): 763—72. PMID 16922804. doi:10.1111/j.1440-1681.2006.04441.x.
^ Mahan D, Shields R (1998). „Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight”. J Anim Sci. 76 (2): 506—12. PMID 9498359.
^ Husted S, Mikkelsen B, Jensen J, Nielsen N (2004). „Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics”. Anal Bioanal Chem. 378 (1): 171—82. PMID 14551660. doi:10.1007/s00216-003-2219-0.
^ Finney L, O'Halloran T (2003). „Transition metal speciation in the cell: insights from the chemistry of metal ion receptors”. Science. 300 (5621): 931—6. Bibcode:2003Sci...300..931F. PMID 12738850. doi:10.1126/science.1085049.
^ Cousins R, Liuzzi J, Lichten L (2006). „Mammalian zinc transport, trafficking, and signals”. J Biol Chem. 281 (34): 24085—9. PMID 16793761. doi:10.1074/jbc.R600011200.
^ Dunn L, Rahmanto Y, Richardson D (2007). „Iron uptake and metabolism in the new millennium”. Trends Cell Biol. 17 (2): 93—100. PMID 17194590. doi:10.1016/j.tcb.2006.12.003.
^ „Metabolizam i faktori koji utiču na brzinu metabolizma - Dijeta.net”. Dijeta.net (на језику: српски). 4. 9. 2016. Приступљено 1. 3. 2018.
^ Nealson K, Conrad P (1999). „Life: past, present and future”. Philos Trans R Soc Lond B Biol Sci. 354 (1392): 1923—39. PMC 1692713 . PMID 10670014. doi:10.1098/rstb.1999.0532.
. PMID 10670014. doi:10.1098/rstb.1999.0532.
↑ 32,032,1 Nelson N, Ben-Shem A (2004). „The complex architecture of oxygenic photosynthesis”. Nat Rev Mol Cell Biol. 5 (12): 971—82. PMID 15573135. doi:10.1038/nrm1525.
^ Häse C, Finkelstein R (1993). „Bacterial extracellular zinc-containing metalloproteases”. Microbiol Rev. 57 (4): 823—37. PMC 372940 . PMID 8302217.
. PMID 8302217.
^ Gupta R, Gupta N, Rathi P (2004). „Bacterial lipases: an overview of production, purification and biochemical properties”. Appl Microbiol Biotechnol. 64 (6): 763—81. PMID 14966663. doi:10.1007/s00253-004-1568-8.
^ Hoyle, T. (1997). „The digestive system: linking theory and practice”. Br J Nurs. 6 (22): 1285—91. PMID 9470654.
^ Souba W, Pacitti A (1992). „How amino acids get into cells: mechanisms, models, menus, and mediators”. JPEN J Parenter Enteral Nutr. 16 (6): 569—78. PMID 1494216. doi:10.1177/0148607192016006569.
^ Barrett M, Walmsley A, Gould G (1999). „Structure and function of facilitative sugar transporters”. Curr Opin Cell Biol. 11 (4): 496—502. PMID 10449337. doi:10.1016/S0955-0674(99)80072-6.
^ Bell G, Burant C, Takeda J, Gould G (1993). „Structure and function of mammalian facilitative sugar transporters”. J Biol Chem. 268 (26): 19161—4. PMID 8366068.
↑ 39,039,1 Bouché C, Serdy S, Kahn C, Goldfine A (2004). „The cellular fate of glucose and its relevance in type 2 diabetes”. Endocr Rev. 25 (5): 807—30. PMID 15466941. doi:10.1210/er.2003-0026. Архивирано из оригинала на датум 04. 12. 2012. Приступљено 05. 04. 2018.
^ Wipperman, Matthew, F.; Thomas, Suzanne, T.; Sampson, Nicole, S. (2014). „Pathogen roid rage: Cholesterol utilization by Mycobacterium tuberculosis”. Crit. Rev. Biochem. Mol. Biol. 49 (4): 269—93. PMC 4255906 . PMID 24611808. doi:10.3109/10409238.2014.895700.
. PMID 24611808. doi:10.3109/10409238.2014.895700.
^ Sakami W, Harrington H (1963). „Amino acid metabolism”. Annu Rev Biochem. 32: 355—98. PMID 14144484. doi:10.1146/annurev.bi.32.070163.002035.
^ Brosnan, J. (2000). „Glutamate, at the interface between amino acid and carbohydrate metabolism”. J Nutr. 130 (4S Suppl): 988S—90S. PMID 10736367.
^ Young V, Ajami A (2001). „Glutamine: the emperor or his clothes?”. J Nutr. 131 (9 Suppl): 2449S—59S; discussion 2486S—7S. PMID 11533293.
^ Miziorko H, Lorimer G (1983). „Ribulose-1,5-bisphosphate carboxylase-oxygenase”. Annu Rev Biochem. 52: 507—35. PMID 6351728. doi:10.1146/annurev.bi.52.070183.002451.
^ Dodd A, Borland A, Haslam R, Griffiths H, Maxwell K (2002). „Crassulacean acid metabolism: plastic, fantastic”. J Exp Bot. 53 (369): 569—80. PMID 11886877. doi:10.1093/jexbot/53.369.569.
^ Hügler M, Wirsen C, Fuchs G, Taylor C, Sievert S (2005). „Evidence for Autotrophic CO2 Fixation via the Reductive Tricarboxylic Acid Cycle by Members of the ɛ Subdivision of Proteobacteria”. J Bacteriol. 187 (9): 3020—7. PMC 1082812 . PMID 15838028. doi:10.1128/JB.187.9.3020-3027.2005.
. PMID 15838028. doi:10.1128/JB.187.9.3020-3027.2005.
^ Strauss G, Fuchs G (1993). „Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle”. Eur J Biochem. 215 (3): 633—43. PMID 8354269. doi:10.1111/j.1432-1033.1993.tb18074.x.
^ Wood, H. (1991). „Life with CO or CO2 and H2 as a source of carbon and energy”. FASEB J. 5 (2): 156—63. PMID 1900793.
^ Shively J, van Keulen G, Meijer W (1998). „Something from almost nothing: carbon dioxide fixation in chemoautotrophs”. Annu Rev Microbiol. 52: 191—230. PMID 9891798. doi:10.1146/annurev.micro.52.1.191.
^ Boiteux A, Hess B (1981). „Design of glycolysis”. Philos Trans R Soc Lond B Biol Sci. 293 (1063): 5—22. Bibcode:1981RSPTB.293....5B. PMID 6115423. doi:10.1098/rstb.1981.0056.
^ Pilkis S, el-Maghrabi M, Claus T (1990). „Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics”. Diabetes Care. 13 (6): 582—99. PMID 2162755. doi:10.2337/diacare.13.6.582.
↑ 52,052,1 Ensign, S. (2006). „Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation”. Mol Microbiol. 61 (2): 274—6. PMID 16856935. doi:10.1111/j.1365-2958.2006.05247.x.
^ Finn P, Dice J (2006). „Proteolytic and lipolytic responses to starvation”. Nutrition. 22 (7–8): 830—44. PMID 16815497. doi:10.1016/j.nut.2006.04.008.
↑ 54,054,1 Kornberg H, Krebs H (1957). „Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle”. Nature. 179 (4568): 988—91. Bibcode:1957Natur.179..988K. PMID 13430766. doi:10.1038/179988a0.
^ Rademacher T, Parekh R, Dwek R (1988). „Glycobiology”. Annu Rev Biochem. 57: 785—838. PMID 3052290. doi:10.1146/annurev.bi.57.070188.004033.
^ Opdenakker G, Rudd P, Ponting C, Dwek R (1993). „Concepts and principles of glycobiology”. FASEB J. 7 (14): 1330—7. PMID 8224606.
^ McConville M, Menon A (2000). „Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review)”. Mol Membr Biol. 17 (1): 1—16. PMID 10824734. doi:10.1080/096876800294443.
^ Chirala S, Wakil S (2004). „Structure and function of animal fatty acid synthase”. Lipids. 39 (11): 1045—53. PMID 15726818. doi:10.1007/s11745-004-1329-9.
^ White S, Zheng J, Zhang Y (2005). „The structural biology of type II fatty acid biosynthesis”. Annu Rev Biochem. 74: 791—831. PMID 15952903. doi:10.1146/annurev.biochem.74.082803.133524.
^ Ohlrogge J, Jaworski J (1997). „Regulation of fatty acid synthesis”. Annu Rev Plant Physiol Plant Mol Biol. 48: 109—136. PMID 15012259. doi:10.1146/annurev.arplant.48.1.109.
^ Dubey V, Bhalla R, Luthra R (2003). „An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants” (PDF). J Biosci. 28 (5): 637—46. PMID 14517367. doi:10.1007/BF02703339. Архивирано из оригинала (PDF) на датум 15. 4. 2007.
↑ 62,062,1 Kuzuyama T, Seto H (2003). „Diversity of the biosynthesis of the isoprene units”. Nat Prod Rep. 20 (2): 171—83. PMID 12735695. doi:10.1039/b109860h.
^ Grochowski L, Xu H, White R (2006). „Methanocaldococcus jannaschii Uses a Modified Mevalonate Pathway for Biosynthesis of Isopentenyl Diphosphate”. J Bacteriol. 188 (9): 3192—8. PMC 1447442 . PMID 16621811. doi:10.1128/JB.188.9.3192-3198.2006.
. PMID 16621811. doi:10.1128/JB.188.9.3192-3198.2006.
^ Lichtenthaler, H. (1999). „The 1-Ddeoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants”. Annu Rev Plant Physiol Plant Mol Biol. 50: 47—65. PMID 15012203. doi:10.1146/annurev.arplant.50.1.47.
↑ 65,065,1 Schroepfer, G. (1981). „Sterol biosynthesis”. Annu Rev Biochem. 50: 585—621. PMID 7023367. doi:10.1146/annurev.bi.50.070181.003101.
^ Lees N, Skaggs B, Kirsch D, Bard M (1995). „Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review”. Lipids. 30 (3): 221—6. PMID 7791529. doi:10.1007/BF02537824.
^ Himmelreich R, Hilbert H, Plagens H, Pirkl E, Li BC, Herrmann R (1996). „Complete sequence analysis of the genome of the bacterium Mycoplasma pneumoniae”. Nucleic Acids Res. 24 (22): 4420—49. PMC 146264 . PMID 8948633. doi:10.1093/nar/24.22.4420.
. PMID 8948633. doi:10.1093/nar/24.22.4420.
^ Guyton & Hall 2006, стр. 855–6
^ Ibba M, Söll D (2001). „The renaissance of aminoacyl-tRNA synthesis”. EMBO Rep. 2 (5): 382—7. PMC 1083889 . PMID 11375928. doi:10.1093/embo-reports/kve095. Архивирано из оригинала на датум 1. 5. 2011.
. PMID 11375928. doi:10.1093/embo-reports/kve095. Архивирано из оригинала на датум 1. 5. 2011.
^ Lengyel P, Söll D (1969). „Mechanism of protein biosynthesis”. Bacteriol Rev. 33 (2): 264—301. PMC 378322 . PMID 4896351.
. PMID 4896351.
↑ 71,071,1 Rudolph, F. (1994). „The biochemistry and physiology of nucleotides”. J Nutr. 124 (1 Suppl): 124S—127S. PMID 8283301. Zrenner R, Stitt M, Sonnewald U, Boldt R (2006). „Pyrimidine and purine biosynthesis and degradation in plants”. Annu Rev Plant Biol. 57: 805—36. PMID 16669783. doi:10.1146/annurev.arplant.57.032905.105421.
^ Stasolla C, Katahira R, Thorpe T, Ashihara H (2003). „Purine and pyrimidine nucleotide metabolism in higher plants”. J Plant Physiol. 160 (11): 1271—95. PMID 14658380. doi:10.1078/0176-1617-01169.
^ Davies O, Mendes P, Smallbone K, Malys N (2012). „Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism”. BMB Reports. 45 (4): 259—64. PMID 22531138. doi:10.5483/BMBRep.2012.45.4.259.
^ Smith, J. (1995). „Enzymes of nucleotide synthesis”. Curr Opin Struct Biol. 5 (6): 752—7. PMID 8749362. doi:10.1016/0959-440X(95)80007-7.
^ Capaldi R, Aggeler R (2002). „Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor”. Trends Biochem Sci. 27 (3): 154—60. PMID 11893513. doi:10.1016/S0968-0004(01)02051-5.
^ Hosler J, Ferguson-Miller S, Mills D (2006). „Energy Transduction: Proton Transfer Through the Respiratory Complexes”. Annu Rev Biochem. 75: 165—87. PMC 2659341 . PMID 16756489. doi:10.1146/annurev.biochem.75.062003.101730.
. PMID 16756489. doi:10.1146/annurev.biochem.75.062003.101730.
^ Schultz B, Chan S (2001). „Structures and proton-pumping strategies of mitochondrial respiratory enzymes”. Annu Rev Biophys Biomol Struct. 30: 23—65. PMID 11340051. doi:10.1146/annurev.biophys.30.1.23.
^ Friedrich B, Schwartz E (1993). „Molecular biology of hydrogen utilization in aerobic chemolithotrophs”. Annu Rev Microbiol. 47: 351—83. PMID 8257102. doi:10.1146/annurev.mi.47.100193.002031.
^ Weber K, Achenbach L, Coates J (2006). „Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction”. Nat Rev Microbiol. 4 (10): 752—64. PMID 16980937. doi:10.1038/nrmicro1490.
^ Jetten M, Strous M, van de Pas-Schoonen K, Schalk J, van Dongen U, van de Graaf A, Logemann S, Muyzer G, van Loosdrecht M, Kuenen J (1998). „The anaerobic oxidation of ammonium”. FEMS Microbiol Rev. 22 (5): 421—37. PMID 9990725. doi:10.1111/j.1574-6976.1998.tb00379.x.
^ Simon, J. (2002). „Enzymology and bioenergetics of respiratory nitrite ammonification”. FEMS Microbiol Rev. 26 (3): 285—309. PMID 12165429. doi:10.1111/j.1574-6976.2002.tb00616.x.
^ Conrad, R. (1996). „Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)”. Microbiol Rev. 60 (4): 609—40. PMC 239458 . PMID 8987358.
. PMID 8987358.
^ Barea J, Pozo M, Azcón R, Azcón-Aguilar C (2005). „Microbial co-operation in the rhizosphere”. J Exp Bot. 56 (417): 1761—78. PMID 15911555. doi:10.1093/jxb/eri197.
^ D.A. Bryant & N.-U. Frigaard (2006). „Prokaryotic photosynthesis and phototrophy illuminated”. Trends Microbiol. 14 (11): 488—96. PMID 16997562. doi:10.1016/j.tim.2006.09.001.
^ Tsygankov, A. A.; Khusnutdinova, A. N. (2015). „Hydrogen in metabolism of purple bacteria and prospects of practical application”. Microbiology. 84 (1): 1—22. doi:10.1134/S0026261715010154. Приступљено 8. 10. 2017.
^ Green BR (2003). Light-Harvesting Antennas in Photosynthesis. стр. 8. ISBN 978-0-7923-6335-4.
^ Sakurai H, Ogawa T, Shiga M, Inoue K (2010). „Inorganic sulfur oxidizing system in green sulfur bacteria”. Photosynthesis Research. 104 (2–3): 163—76. PMID 20143161. doi:10.1007/s11120-010-9531-2.
^ van der Meer M, Schouten S, Bateson M, Nübel U, Wieland A, Kühl M, de Leeuw J, Sinninghe Damsté J, Ward D (2005). „Diel Variations in Carbon Metabolism by Green Nonsulfur-Like Bacteria in Alkaline Siliceous Hot Spring Microbial Mats from Yellowstone National Park”. Appl Environ Microbiol. 71 (7): 3978—86. PMC 1168979 . PMID 16000812. doi:10.1128/AEM.71.7.3978-3986.2005.
. PMID 16000812. doi:10.1128/AEM.71.7.3978-3986.2005.
^ Tichi M, Tabita F (2001). „Interactive Control of Rhodobacter capsulatus Redox-Balancing Systems during Phototrophic Metabolism”. J Bacteriol. 183 (21): 6344—54. PMC 100130 . PMID 11591679. doi:10.1128/JB.183.21.6344-6354.2001.
. PMID 11591679. doi:10.1128/JB.183.21.6344-6354.2001.
^ Allen J, Williams J (1998). „Photosynthetic reaction centers”. FEBS Lett. 438 (1–2): 5—9. PMID 9821949. doi:10.1016/S0014-5793(98)01245-9.
^ Munekage Y, Hashimoto M, Miyake C, Tomizawa K, Endo T, Tasaka M, Shikanai T (2004). „Cyclic electron flow around photosystem I is essential for photosynthesis”. Nature. 429 (6991): 579—82. Bibcode:2004Natur.429..579M. PMID 15175756. doi:10.1038/nature02598.
^ Carroll & Salt 2004, стр. 93
^ Kuypers, MMM; Marchant, HK; Kartal, B (2011). „The Microbial Nitrogen-Cycling Network”. Nature Reviews Microbiology. 1 (1): 1—14. PMID 29398704. doi:10.1038/nrmicro.2018.9.
^ Galloway, J. N.; et al. (2004). „Nitrogen cycles: past, present, and future generations”. Biogeochemistry. 70: 153—226. doi:10.1007/s10533-004-0370-0.
^ Sigel, Sigel & Sigel 2007, стр. 561–97
^ Nelson, D. „Cytochrome P450 Homepage”. University of Tennessee. Приступљено 13. 11. 2014.
^ Habig WH, Pabst MJ, Jakoby WB (1974). „Glutathione S-transferases. The first enzymatic step in mercapturic acid formation”. J. Biol. Chem. 249: 7130—7139. PMID 4436300.
^ Jakoby, W.B. (1978). „The glutathione S-transferases: a group of multifunctional detoxification proteins”. Adv. Enzymol. Relat. Areas Mol. Biol. 46: 383—383. PMID 345769.
^ Jakoby, W.B. (1985). „Glutathione transferases: an overview”. Methods Enzymol. 113: 495—499. PMID 4088070.
^ Keen, J.H. & Jakoby, W.B. (1978). „Glutathione transferases. Catalysis of nucleophilic reactions of glutathione”. J. Biol. Chem. 253: 5654—5657. PMID 670218.
^ Sheehan D, Meade G, Foley VM, Dowd CA (2001). „Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily”. Biochem. J. 360: 1—16. PMID 11695986.
^ PDB: 1R5A; Udomsinprasert R, Pongjaroenkit S, Wongsantichon J, Oakley AJ, Prapanthadara LA, Wilce MC, Ketterman AJ (2005). „Identification, characterization and structure of a new Delta class glutathione transferase isoenzyme”. Biochem. J. 388 (Pt 3): 763—71. PMC 1183455 . PMID 15717864. doi:10.1042/BJ20042015.
. PMID 15717864. doi:10.1042/BJ20042015.
^ „Toxicology Primer”. UIC. Архивирано из оригинала на датум 31. 10. 2013. Приступљено 21. 4. 2013.
^ Testa B, Krämer S (2006). „The biochemistry of drug metabolism—an introduction: part 1. Principles and overview”. Chem Biodivers. 3 (10): 1053—101. PMID 17193224. doi:10.1002/cbdv.200690111.
^ Danielson, P. (2002). „The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans”. Curr Drug Metab. 3 (6): 561—97. PMID 12369887. doi:10.2174/1389200023337054.
^ King C, Rios G, Green M, Tephly T (2000). „UDP-glucuronosyltransferases”. Curr Drug Metab. 1 (2): 143—61. PMID 11465080. doi:10.2174/1389200003339171.
^ Sheehan D, Meade G, Foley V, Dowd C (2001). „Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily”. Biochem J. 360 (Pt 1): 1—16. PMC 1222196 . PMID 11695986. doi:10.1042/0264-6021:3600001.
. PMID 11695986. doi:10.1042/0264-6021:3600001.
^ Galvão T, Mohn W, de Lorenzo V (2005). „Exploring the microbial biodegradation and biotransformation gene pool”. Trends Biotechnol. 23 (10): 497—506. PMID 16125262. doi:10.1016/j.tibtech.2005.08.002.
^ Janssen D, Dinkla I, Poelarends G, Terpstra P (2005). „Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities”. Environ Microbiol. 7 (12): 1868—82. PMID 16309386. doi:10.1111/j.1462-2920.2005.00966.x.
^ Davies, K. (1995). „Oxidative stress: the paradox of aerobic life”. Biochem Soc Symp. 61: 1—31. PMID 8660387. doi:10.1042/bss0610001.
^ Tu B, Weissman J (2004). „Oxidative protein folding in eukaryotes: mechanisms and consequences”. J Cell Biol. 164 (3): 341—6. PMC 2172237 . PMID 14757749. doi:10.1083/jcb.200311055.
. PMID 14757749. doi:10.1083/jcb.200311055.
^ Sies, H. (1997). „Oxidative stress: oxidants and antioxidants” (PDF). Exp Physiol. 82 (2): 291—5. PMID 9129943. doi:10.1113/expphysiol.1997.sp004024.
^ Vertuani S, Angusti A, Manfredini S (2004). „The antioxidants and pro-antioxidants network: an overview”. Curr Pharm Des. 10 (14): 1677—94. PMID 15134565. doi:10.2174/1381612043384655.
↑ 114,0114,1114,2 Jakoby WB, Ziegler DM (1990). „The enzymes of detoxication”. J. Biol. Chem. 265 (34): 20715—8. PMID 2249981.
^ Mizuno N, Niwa T, Yotsumoto Y, Sugiyama Y (2003). „Impact of drug transporter studies on drug discovery and development”. Pharmacol. Rev. 55 (3): 425—61. PMID 12869659. doi:10.1124/pr.55.3.1.
↑ 116,0116,1 Thornalley, P. J. (1990). „The glyoxalase system: new developments towards functional characterization of a metabolic pathway fundamental to biological life”. Biochem. J. 269 (1): 1—11. PMC 1131522 . PMID 2198020.
. PMID 2198020.
↑ 117,0117,1 Sies, H. (1997). „Oxidative stress: oxidants and antioxidants” (PDF). Exp. Physiol. 82 (2): 291—5. PMID 9129943. doi:10.1113/expphysiol.1997.sp004024.
^ Guengerich, F. P. (2001). „Common and uncommon cytochrome P450 reactions related to metabolism and chemical toxicity”. Chem. Res. Toxicol. 14 (6): 611—50. PMID 11409933. doi:10.1021/tx0002583.
^ Schlichting I, Berendzen J, Chu K, Stock AM, Maves SA, Benson DE, Sweet RM, Ringe D, Petsko GA, Sligar SG (2000). „The catalytic pathway of cytochrome p450cam at atomic resolution”. Science. 287 (5458): 1615—22. Bibcode:2000Sci...287.1615S. PMID 10698731. doi:10.1126/science.287.5458.1615.
^ „Acetonitrile (EHC 154, 1993)”. www.inchem.org. Приступљено 3. 5. 2017.
^ Akagah B, Lormier AT, Fournet A, Figadère B (2008). „Oxidation of antiparasitic 2-substituted quinolines using metalloporphyrin catalysts: scale-up of a biomimetic reaction for metabolite production of drug candidates”. Org. Biomol. Chem. 6 (24): 4494—7. PMID 19039354. doi:10.1039/b815963g.
↑ 122,0122,1122,2122,3122,4 Liston HL, Markowitz JS, DeVane CL (2001). „Drug glucuronidation in clinical psychopharmacology”. J Clin Psychopharmacol. 21 (5): 500—15. PMID 11593076. doi:10.1097/00004714-200110000-00008.
^ Badenhorst CP, van der Sluis R, Erasmus E, van Dijk AA (2013). „Glycine conjugation: importance in metabolism, the role of glycine N-acyltransferase, and factors that influence interindividual variation”. Expert Opinion on Drug Metabolism & Toxicology. 9 (9): 1139—1153. PMID 23650932. doi:10.1517/17425255.2013.796929.
^ Boyland E, Chasseaud LF (1969). „The role of glutathione and glutathione S-transferases in mercapturic acid biosynthesis”. Adv. Enzymol. Relat. Areas Mol. Biol. Advances in Enzymology – and Related Areas of Molecular Biology. 32: 173—219. ISBN 9780470122778. PMID 4892500. doi:10.1002/9780470122778.ch5.
^ Homolya L, Váradi A, Sarkadi B (2003). „Multidrug resistance-associated proteins: Export pumps for conjugates with glutathione, glucuronate or sulfate”. BioFactors. 17 (1–4): 103—14. PMID 12897433. doi:10.1002/biof.5520170111.
^ König J, Nies AT, Cui Y, Leier I, Keppler D (1999). „Conjugate export pumps of the multidrug resistance protein (MRP) family: localization, substrate specificity, and MRP2-mediated drug resistance”. Biochim. Biophys. Acta. 1461 (2): 377—94. PMID 10581368. doi:10.1016/S0005-2736(99)00169-8.
^ Commandeur JN, Stijntjes GJ, Vermeulen NP (1995). „Enzymes and transport systems involved in the formation and disposition of glutathione S-conjugates. Role in bioactivation and detoxication mechanisms of xenobiotics”. Pharmacol. Rev. 47 (2): 271—330. PMID 7568330.
^ Rostami-Hodjegan A, Tucker GT (2007). „Simulation and prediction of in vivo drug metabolism in human populations from in vitro data”. Nat Rev Drug Discov. 6 (2): 140—8. PMID 17268485. doi:10.1038/nrd2173.
^ von Stockar U, Liu J (1999). „Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth”. Biochim Biophys Acta. 1412 (3): 191—211. PMID 10482783. doi:10.1016/S0005-2728(99)00065-1.
^ Demirel Y, Sandler S (2002). „Thermodynamics and bioenergetics”. Biophys Chem. 97 (2–3): 87—111. PMID 12050002. doi:10.1016/S0301-4622(02)00069-8.
^ M.J. Farabee. „Reactions and Enzymes”. On-Line Biology Book. Estrella Mountain Community College. Архивирано из оригинала на датум 28. 12. 2012. Приступљено 12. 04. 2018.
^ Haynie 2001, стр. 1–16
^ Albert, R. (2005). „Scale-free networks in cell biology”. J Cell Sci. 118 (Pt 21): 4947—57. PMID 16254242. doi:10.1242/jcs.02714.
^ Brand, M. (1997). „Regulation analysis of energy metabolism”. J Exp Biol. 200 (Pt 2): 193—202. PMID 9050227.
^ Soyer O, Salathé M, Bonhoeffer S (2006). „Signal transduction networks: topology, response and biochemical processes”. J Theor Biol. 238 (2): 416—25. PMID 16045939. doi:10.1016/j.jtbi.2005.05.030.
↑ 136,0136,1 Salter M, Knowles R, Pogson C (1994). „Metabolic control”. Essays Biochem. 28: 1—12. PMID 7925313.
^ Westerhoff H, Groen A, Wanders R (1984). „Modern theories of metabolic control and their applications (review)”. Biosci Rep. 4 (1): 1—22. PMID 6365197. doi:10.1007/BF01120819.
^ Fell D, Thomas S (1995). „Physiological control of metabolic flux: the requirement for multisite modulation”. Biochem J. 311 (Pt 1): 35—9. PMC 1136115 . PMID 7575476.
. PMID 7575476.
^ Hendrickson, W. (2005). „Transduction of biochemical signals across cell membranes”. Q Rev Biophys. 38 (4): 321—30. PMID 16600054. doi:10.1017/S0033583506004136.
^ Cohen, P. (2000). „The regulation of protein function by multisite phosphorylation—a 25 year update”. Trends Biochem Sci. 25 (12): 596—601. PMID 11116185. doi:10.1016/S0968-0004(00)01712-6.
^ Lienhard G, Slot J, James D, Mueckler M (1992). „How cells absorb glucose”. Sci Am. 266 (1): 86—91. PMID 1734513. doi:10.1038/scientificamerican0192-86.
^ Roach, P. (2002). „Glycogen and its metabolism”. Curr Mol Med. 2 (2): 101—20. PMID 11949930. doi:10.2174/1566524024605761.
^ Newgard C, Brady M, O'Doherty R, Saltiel A (2000). „Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1” (PDF). Diabetes. 49 (12): 1967—77. PMID 11117996. doi:10.2337/diabetes.49.12.1967.
↑ 144,0144,1 Nelson, DL; Cox, MM (2009). Lehninger: Principios de bioquímica (5th изд.). Barcelona: Omega. стр. 220—228. ISBN 978-84-282-1486-5.
^ Copley, SD (2012). „Moonlighting is Mainstream: Paradigm Adjustment Required”. BioEssays. 34 (7): 578—588. PMID 22696112. doi:10.1002/bies.201100191.
^ Romano A, Conway T (1996). „Evolution of carbohydrate metabolic pathways”. Res Microbiol. 147 (6–7): 448—55. PMID 9084754. doi:10.1016/0923-2508(96)83998-2.
^ Koch, A. (1998). „How did bacteria come to be?”. Adv Microb Physiol. Advances in Microbial Physiology. 40: 353—99. ISBN 978-0-12-027740-7. PMID 9889982. doi:10.1016/S0065-2911(08)60135-6.
^ Ouzounis C, Kyrpides N (1996). „The emergence of major cellular processes in evolution”. FEBS Lett. 390 (2): 119—23. PMID 8706840. doi:10.1016/0014-5793(96)00631-X.
^ Caetano-Anolles G, Kim HS, Mittenthal JE (2007). „The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture”. Proc Natl Acad Sci USA. 104 (22): 9358—63. Bibcode:2007PNAS..104.9358C. PMC 1890499 . PMID 17517598. doi:10.1073/pnas.0701214104.
. PMID 17517598. doi:10.1073/pnas.0701214104.
^ Schmidt S, Sunyaev S, Bork P, Dandekar T (2003). „Metabolites: a helping hand for pathway evolution?”. Trends Biochem Sci. 28 (6): 336—41. PMID 12826406. doi:10.1016/S0968-0004(03)00114-2.
^ Light S, Kraulis P (2004). „Network analysis of metabolic enzyme evolution in Escherichia coli”. BMC Bioinformatics. 5: 15. PMC 394313 . PMID 15113413. doi:10.1186/1471-2105-5-15. Alves R, Chaleil R, Sternberg M (2002). „Evolution of enzymes in metabolism: a network perspective”. J Mol Biol. 320 (4): 751—70. PMID 12095253. doi:10.1016/S0022-2836(02)00546-6.
. PMID 15113413. doi:10.1186/1471-2105-5-15. Alves R, Chaleil R, Sternberg M (2002). „Evolution of enzymes in metabolism: a network perspective”. J Mol Biol. 320 (4): 751—70. PMID 12095253. doi:10.1016/S0022-2836(02)00546-6.
^ Kim HS, Mittenthal JE, Caetano-Anolles G (2006). „MANET: tracing evolution of protein architecture in metabolic networks”. BMC Bioinformatics. 7: 351. PMC 1559654 . PMID 16854231. doi:10.1186/1471-2105-7-351.
. PMID 16854231. doi:10.1186/1471-2105-7-351.
^ Teichmann SA, Rison SC, Thornton JM, Riley M, Gough J, Chothia C (2001). „Small-molecule metabolsim: an enzyme mosaic”. Trends Biotechnol. 19 (12): 482—6. PMID 11711174. doi:10.1016/S0167-7799(01)01813-3.
^ Spirin V, Gelfand M, Mironov A, Mirny L (2006). „A metabolic network in the evolutionary context: Multiscale structure and modularity”. Proc Natl Acad Sci USA. 103 (23): 8774—9. Bibcode:2006PNAS..103.8774S. PMC 1482654 . PMID 16731630. doi:10.1073/pnas.0510258103.
. PMID 16731630. doi:10.1073/pnas.0510258103.
^ Lawrence, J. (2005). „Common themes in the genome strategies of pathogens”. Curr Opin Genet Dev. 15 (6): 584—8. PMID 16188434. doi:10.1016/j.gde.2005.09.007. Wernegreen, J. (2005). „For better or worse: genomic consequences of intracellular mutualism and parasitism”. Curr Opin Genet Dev. 15 (6): 572—83. PMID 16230003. doi:10.1016/j.gde.2005.09.013.
^ Pál C, Papp B, Lercher M, Csermely P, Oliver S, Hurst L (2006). „Chance and necessity in the evolution of minimal metabolic networks”. Nature. 440 (7084): 667—70. Bibcode:2006Natur.440..667P. PMID 16572170. doi:10.1038/nature04568.
^ Rennie, M. (1999). „An introduction to the use of tracers in nutrition and metabolism”. Proc Nutr Soc. 58 (4): 935—44. PMID 10817161. doi:10.1017/S002966519900124X.
^ Phair, R. (1997). „Development of kinetic models in the nonlinear world of molecular cell biology”. Metabolism. 46 (12): 1489—95. PMID 9439549. doi:10.1016/S0026-0495(97)90154-2.
^ Sterck L, Rombauts S, Vandepoele K, Rouzé P, Van de Peer Y (2007). „How many genes are there in plants (... and why are they there)?”. Curr Opin Plant Biol. 10 (2): 199—203. PMID 17289424. doi:10.1016/j.pbi.2007.01.004.
^ Borodina I, Nielsen J (2005). „From genomes to in silico cells via metabolic networks”. Curr Opin Biotechnol. 16 (3): 350—5. PMID 15961036. doi:10.1016/j.copbio.2005.04.008.
^ Gianchandani E, Brautigan D, Papin J (2006). „Systems analyses characterize integrated functions of biochemical networks”. Trends Biochem Sci. 31 (5): 284—91. PMID 16616498. doi:10.1016/j.tibs.2006.03.007.
^ Duarte NC, Becker SA, Jamshidi N, et al. (2007). „Global reconstruction of the human metabolic network based on genomic and bibliomic data”. Proc. Natl. Acad. Sci. U.S.A. 104 (6): 1777—82. Bibcode:2007PNAS..104.1777D. PMC 1794290 . PMID 17267599. doi:10.1073/pnas.0610772104.
. PMID 17267599. doi:10.1073/pnas.0610772104.
^ Goh KI, Cusick ME, Valle D, Childs B, Vidal M, Barabási AL (2007). „The human disease network”. Proc. Natl. Acad. Sci. U.S.A. 104 (21): 8685—90. Bibcode:2007PNAS..104.8685G. PMC 1885563 . PMID 17502601. doi:10.1073/pnas.0701361104.
. PMID 17502601. doi:10.1073/pnas.0701361104.
^ Lee DS, Park J, Kay KA, Christakis NA, Oltvai ZN, Barabási AL (2008). „The implications of human metabolic network topology for disease comorbidity”. Proc. Natl. Acad. Sci. U.S.A. 105 (29): 9880—9885. Bibcode:2008PNAS..105.9880L. PMC 2481357 . PMID 18599447. doi:10.1073/pnas.0802208105.
. PMID 18599447. doi:10.1073/pnas.0802208105.
^ Csete M, Doyle J (2004). „Bow ties, metabolism and disease”. Trends Biotechnol. 22 (9): 446—50. PMID 15331224. doi:10.1016/j.tibtech.2004.07.007.
^ Ma HW, Zeng AP (2003). „The connectivity structure, giant strong component and centrality of metabolic networks”. Bioinformatics. 19 (11): 1423—30. CiteSeerX 10.1.1.605.8964 . PMID 12874056. doi:10.1093/bioinformatics/btg177.
. PMID 12874056. doi:10.1093/bioinformatics/btg177.
^ Zhao J, Yu H, Luo JH, Cao ZW, Li YX (2006). „Hierarchical modularity of nested bow-ties in metabolic networks”. BMC Bioinformatics. 7: 386. PMC 1560398 . PMID 16916470. doi:10.1186/1471-2105-7-386.
. PMID 16916470. doi:10.1186/1471-2105-7-386.
^ Thykaer J, Nielsen J (2003). „Metabolic engineering of beta-lactam production”. Metab Eng. 5 (1): 56—69. PMID 12749845. doi:10.1016/S1096-7176(03)00003-X.
^ González-Pajuelo M, Meynial-Salles I, Mendes F, Andrade J, Vasconcelos I, Soucaille P (2005). „Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol”. Metab Eng. 7 (5–6): 329—36. PMID 16095939. doi:10.1016/j.ymben.2005.06.001.
^ Krämer M, Bongaerts J, Bovenberg R, Kremer S, Müller U, Orf S, Wubbolts M, Raeven L (2003). „Metabolic engineering for microbial production of shikimic acid”. Metab Eng. 5 (4): 277—83. PMID 14642355. doi:10.1016/j.ymben.2003.09.001.
^ Koffas M, Roberge C, Lee K, Stephanopoulos G (1999). „Metabolic engineering”. Annu Rev Biomed Eng. 1: 535—57. PMID 11701499. doi:10.1146/annurev.bioeng.1.1.535.
^ „Metabolism”. The Online Etymology Dictionary. Приступљено 20. 2. 2007.
^ Leroi, Armand Marie (2014). The Lagoon: How Aristotle Invented Science. Bloomsbury. стр. 400—401. ISBN 978-1-4088-3622-4.
^ Dr. Abu Shadi Al-Roubi (1982), "Ibn Al-Nafis as a philosopher", Symposium on Ibn al-Nafis, Second International Conference on Islamic Medicine: Islamic Medical Organization, Kuwait (cf. Ibn al-Nafis As a Philosopher, Encyclopedia of Islamic World [1])
^ Eknoyan, G. (1999). „Santorio Sanctorius (1561–1636) – founding father of metabolic balance studies”. Am J Nephrol. 19 (2): 226—33. PMID 10213823. doi:10.1159/000013455.
^ Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (New York) Retrieved on 2007-03-26
^ Dubos J. (1951). „Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)—chance and the prepared mind”. Trends Biotechnol. 13 (12): 511—515. PMID 8595136. doi:10.1016/S0167-7799(00)89014-9.
^ Kinne-Saffran E, Kinne R (1999). „Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs”. Am J Nephrol. 19 (2): 290—4. PMID 10213830. doi:10.1159/000013463.
^ Murphy, P. J. (2001). „Xenobiotic metabolism: a look from the past to the future”. Drug Metab. Dispos. 29 (6): 779—80. PMID 11353742.
^ Eduard Buchner's 1907 Nobel lecture at http://nobelprize.org Accessed 2007-03-20
^ Kornberg, H. (2000). „Krebs and his trinity of cycles”. Nat Rev Mol Cell Biol. 1 (3): 225—8. PMID 11252898. doi:10.1038/35043073.
^ M., Cox, Michael (1. 1. 2013). Lehninger principles of biochemistry. Freeman. ISBN 9781429234146. OCLC 901647690.
^ Krebs HA, Henseleit K (1932). „Untersuchungen über die Harnstoffbildung im tierkorper”. Z. Physiol. Chem. 210: 33—66. doi:10.1515/bchm2.1932.210.1-2.33.
^ Krebs H, Johnson W (1937). „Metabolism of ketonic acids in animal tissues”. Biochem J. 31 (4): 645—60. PMC 1266984 . PMID 16746382. doi:10.1042/bj0310645.
. PMID 16746382. doi:10.1042/bj0310645.
^ Neuberger A, Smith RL (1983). „Richard Tecwyn Williams: the man, his work, his impact”. Drug Metab. Rev. 14 (3): 559—607. PMID 6347595. doi:10.3109/03602538308991399.
^ Booth J, Boyland E, Sims P (1961). „An enzyme from rat liver catalysing conjugations with glutathione”. Biochem. J. 79 (3): 516—24. PMC 1205680 . PMID 16748905.
. PMID 16748905.
^ Omura T, Sato R (1962). „A new cytochrome in liver microsomes”. J. Biol. Chem. 237: 1375—6. PMID 14482007.
^ Estabrook, R. W. (2003). „A passion for P450s (remembrances of the early history of research on cytochrome P450)”. Drug Metab. Dispos. 31 (12): 1461—73. PMID 14625342. doi:10.1124/dmd.31.12.1461.
^ Estabrook RW, Cooper DY, Rosenthal O (1963). „The light reversible carbon monoxide inhibition of steroid C-21 hydroxylase system in adrenal cortex”. Biochem Z. 338: 741—55. PMID 14087340.
Литература
.mw-parser-output .refbeginfont-size:90%;margin-bottom:0.5em.mw-parser-output .refbegin-hanging-indents>ullist-style-type:none;margin-left:0.mw-parser-output .refbegin-hanging-indents>ul>li,.mw-parser-output .refbegin-hanging-indents>dl>ddmargin-left:0;padding-left:3.2em;text-indent:-3.2em;list-style:none.mw-parser-output .refbegin-100font-size:100%
Coulston, Ann; Kerner, John; Hattner, JoAnn; Srivastava, Ashini (2006). „Nutrition Principles and Clinical Nutrition”. Stanford School of Medicine Nutrition Courses. SUMMIT.
M.J. Farabee. „Reactions and Enzymes”. On-Line Biology Book. Estrella Mountain Community College. Архивирано из оригинала на датум 28. 12. 2012. Приступљено 12. 04. 2018.
Carroll, Steven B.; Salt, Steven D. (2004). Ecology for gardeners. Timber Press. стр. 93. ISBN 978-0-88192-611-8.
Guyton, Arthur C.; Hall, John E. (2006). Textbook of Medical Physiology. Philadelphia: Elsevier. стр. 855—6. ISBN 978-0-7216-0240-0.- { url =
Guyton, Arthur C.; Hall, John E. (2006). Textbook of Medical Physiology. Philadelphia: Elsevier. стр. 855—6. ISBN 978-0-7216-0240-0.
Nelson, David L.; Cox, Michael M. (2005). Lehninger Principles of Biochemistry. New York: W. H. Freeman and company. стр. 841. ISBN 978-0-7167-4339-2.
Rose, S.; Mileusnic, R. (1999). The Chemistry of Life. (Penguin Press Science). ISBN 978-0-14-027273-4.
Schneider, E. D.; Sagan, D. (2005). Into the Cool: Energy Flow, Thermodynamics, and Life. University Of Chicago Press. ISBN 978-0-226-73936-6.
Lane, N. (2004). Oxygen: The Molecule that Made the World. (Oxford University Press. USA). ISBN 978-0-19-860783-0.
Price, N.; Stevens, L. Fundamentals of Enzymology: Cell and Molecular Biology of Catalytic Proteins. (Oxford University Press. 1999). ISBN 978-0-19-850229-6.
Berg, J.; Tymoczko, J.; Stryer, L. (2002). Biochemistry. (W. H. Freeman and Company). ISBN 978-0-7167-4955-4.
Cox, M.; Nelson, D. L. (2004). Lehninger Principles of Biochemistry. (Palgrave Macmillan). ISBN 978-0-7167-4339-2.
Brock, Thomas D.; Madigan, M. T.; Martinko, J.; Parker J. (2002). Brock's Biology of Microorganisms. (Benjamin Cummings). ISBN 978-0-13-066271-2.
Da Silva, J.J.R.F.; Williams, R. J. P. The Biological Chemistry of the Elements: The Inorganic Chemistry of Life. (Clarendon Press. 1991). ISBN 978-0-19-855598-8.
Nicholls, D. G.; Ferguson, S. J. (2002). Bioenergetics. (Academic Press Inc.). ISBN 978-0-12-518121-1.
Parvez H, Reiss C (2001). Molecular Responses to Xenobiotics. Elsevier. ISBN 978-0-345-42277-4.
Ioannides, C. (2001). Enzyme Systems That Metabolise Drugs and Other Xenobiotics. John Wiley and Sons. ISBN 978-0-471-89466-7.
Richardson, M. (1996). Environmental Xenobiotics. Taylor & Francis Ltd. ISBN 978-0-7484-0399-8.
Ioannides, C. (1996). Cytochromes P450: Metabolic and Toxicological Aspects. CRC Press Inc. ISBN 978-0-8493-9224-5.
Awasthi, Y. C. (2006). Toxicology of Glutathionine S-transferses. CRC Press Inc. ISBN 978-0-8493-2983-8.
Haynie, D. (2001). Biological Thermodynamics. Cambridge: Cambridge University Press.
Alberty, Robert A. (2006). Biochemical Thermodynamics: Applications of Mathematica. Methods of Biochemical Analysis. Wiley-Interscience.
Спољашње везе
Метаболизам на Викимедијиној остави. |
Преглед биохемије школски ниво
МИТ Биологија, водич за молекуларну биологију
Људски метаболизам
Теме у медицинској биохемији, водич за људске метаболичке путеве, школски ниво
Медицинска биохемија, опширни ресурс о људском метаболизму
Базе података
Графикон протока метаболичких путева, ExPASy- SuperCYP: База података о цитохромном метаболизму лекова
Метаболички путеви
- Референца метаболичких путеваy
- The Nitrogen cycle and Nitrogen fixation
Категорија:
- Метаболизам
(RLQ=window.RLQ||[]).push(function()mw.config.set("wgPageParseReport":"limitreport":"cputime":"4.004","walltime":"4.239","ppvisitednodes":"value":12031,"limit":1000000,"ppgeneratednodes":"value":0,"limit":1500000,"postexpandincludesize":"value":624628,"limit":2097152,"templateargumentsize":"value":24775,"limit":2097152,"expansiondepth":"value":11,"limit":40,"expensivefunctioncount":"value":0,"limit":500,"unstrip-depth":"value":0,"limit":20,"unstrip-size":"value":287430,"limit":5000000,"entityaccesscount":"value":1,"limit":400,"timingprofile":["100.00% 3468.353 1 -total"," 74.67% 2589.922 1 Шаблон:Reflist"," 62.71% 2174.925 171 Шаблон:Cite_journal"," 12.26% 425.133 28 Шаблон:Cite_book"," 3.16% 109.550 1 Шаблон:Commonscat"," 2.81% 97.541 4 Шаблон:Navbox"," 1.57% 54.557 1 Шаблон:Метаболизам"," 1.38% 47.841 5 Шаблон:Cite_web"," 1.18% 40.913 1 Шаблон:Мапа_Метаболизма"," 1.03% 35.771 1 Шаблон:Изабрани"],"scribunto":"limitreport-timeusage":"value":"2.680","limit":"10.000","limitreport-memusage":"value":5574034,"limit":52428800,"cachereport":"origin":"mw1331","timestamp":"20190617215816","ttl":2592000,"transientcontent":false););"@context":"https://schema.org","@type":"Article","name":"u041cu0435u0442u0430u0431u043eu043bu0438u0437u0430u043c","url":"https://sr.wikipedia.org/wiki/%D0%9C%D0%B5%D1%82%D0%B0%D0%B1%D0%BE%D0%BB%D0%B8%D0%B7%D0%B0%D0%BC","sameAs":"http://www.wikidata.org/entity/Q1057","mainEntity":"http://www.wikidata.org/entity/Q1057","author":"@type":"Organization","name":"u0421u0430u0440u0430u0434u043du0438u0446u0438 u043fu0440u043eu0458u0435u043au0430u0442u0430 u0412u0438u043au0438u043cu0435u0434u0438u0458u0435","publisher":"@type":"Organization","name":"Wikimedia Foundation, Inc.","logo":"@type":"ImageObject","url":"https://www.wikimedia.org/static/images/wmf-hor-googpub.png","datePublished":"2005-12-06T18:47:56Z","dateModified":"2019-02-18T05:23:42Z","image":"https://upload.wikimedia.org/wikipedia/commons/a/ab/Cytochrome_C_Oxidase_1OCC_in_Membrane_2.png","headline":"u0441u0435u0442 u0445u0435u043cu0438u0458u0441u043au0438u0445 u0440u0435u0430u043au0446u0438u0458u0430 u0438 u043fu0443u0442u0435u0432u0430 u043au043eu0458u0438u043cu0430 u0436u0438u0432u0438 u043eu0440u0433u0430u043du0438u0437u043cu0438 u0442u0440u0430u043du0441u0444u043eu0440u043cu0438u0448u0443 u0445u0435u043cu0438u0458u0441u043au0435 u0441u0443u043fu0441u0442u0430u043du0446u0435"(RLQ=window.RLQ||[]).push(function()mw.config.set("wgBackendResponseTime":173,"wgHostname":"mw1256"););